Основные технические характеристики батареек AA и AAA
Основное, чем различаются пальчиковые батарейки форм-факторов АА и ААА – размер. А он, как уже сказано, определяет ёмкость.
В зависимости от типоразмера и технологии батарейки имеют различный вес, хотя эта характеристика редко бывает определяющей – масса аппаратуры в большинстве случаев значительно превышает вес нескольких батарей. Чаще это надо знать для целей хранения и перевозки гальванических элементов.
Срок хранения определяется током саморазряда и ёмкостью элемента. Саморазряд зависит от технологии, ёмкость – от форм-фактора. Но на практике вторая характеристика вносит меньший вклад в утечку заряда при хранении. По крайней мере, так уверяют производители, указывая примерно одинаковые периоды нахождения на складах для элементов АА и ААА. На срок хранения также влияет температура – с её ростом период сохранности снижается.
Источники питания могут эксплуатироваться в различных условиях, в том числе и по температуре. И приспособленность гальванических элементов будет разная – также в зависимости от технологии изготовления. Упоминалось, что солевые батарейки плохо работают при температурах ниже нуля. Литиевые, несмотря на все свои преимущества, имеют верхнее ограничение в +55 °С (нижний предел – до минус 40 (обычно до минус 20) в зависимости от производителя). Щелочные имеют широкий диапазон — примерно от минус 30 до +60 °С и являются наиболее универсальными в этом отношении.
Подытоживая, надо отметить, что в семейство АА и ААА фактически включено большое количество вариаций гальванических элементов. Можно подобрать батарейку для обширного круга условий эксплуатации и широкого диапазона стоимости.
Какие основные виды аккумуляторных батареек существуют?
Какие существуют виды источников электрического тока?
Как устроен электрический аккумулятор, его принцип работы, виды, назначение и основные характеристики
Что такое литий ионный аккумулятор — устройство и виды
В чём и как измеряется емкость аккумулятора?
Как правильно выбрать аккумулятор для автомобиля?
Какими бывают батарейки
Существует целых три классификации батареек. Первая – по типоразмеру гальванического элемента. В быту мы чаще всего пользуемся батарейками “пальчиковыми” или “мизинчиковыми”, но помимо этого есть ещё средняя и большая батарейки цилиндрической формы, а также два типа батареек, форма которых – параллелепипед: “крона” и просто квадратная. Это – перечень самых распространённых разновидностей формы.
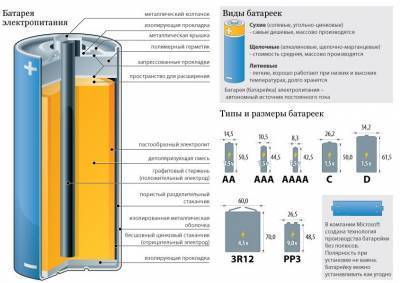
Отличаются автономные источники питания и по типу электролита. Самые дешёвые батарейки, как правило, “солевые” – угольно-цинковые, этот электролит сухой. Ещё один вариант сухого электролита – хлорид цинка. Такие батарейки тоже достаточно дёшевы и широко распространены.
Следующий вариант электролита – щелочной. На этих батарейках написано Alkaline
, а внутри – щёлочно-марганцевый, марганцево-цинковый электролит. Их основной недостаток – высокое содержание ртути.
Батарейки с ртутным электролитом на сегодняшний день практически не производятся. Серебряный электролит показывает хорошие эксплуатационные свойства, однако производство таких батареек стоит очень больших денег.
Воздушно-цинковый электролит – самый безопасный для человека и окружающей среды. Стоят они недорого, хранятся долго. Вот только толщина батарейки в 1,5 раза больше обычной щелочной/серебряной. Кроме того, чтобы исключить саморазряд во время её хранения, требуется заклеивать батарейку. Литиевые батареи – довольно дороги, однако их эксплуатационные характеристики значительно превышают показатели прочих батареек.
Ещё один способ поделить батарейки на группы – определить тип химической реакции, который в них происходит. Первичная реакция происходит в гальванических элементах – в самых обыкновенных батарейках. Вторичной зарядке они не поддаются, в отличие от аккумуляторных батарей, в которых происходит вторичная хим.реакция.
Правила использования и утилизации
Батарейки нежелательно применять при крайних температурах – сильно охлаждать или нагревать. Это может привести к весьма неприятным последствиям. Если вам пришлось использовать батарейки в холоде, например, зимой на улице, рекомендуется не менее получаса выдержать их в комнатной температуре.
Случается, что батарейки, особенно щелочные, текут. Такое происходит когда нарушается герметичность корпуса батарейки. Использовать эти батарейки ни в коем случае нельзя – это может привести к повреждениям электроприборов.
Что касается утилизации отработанных батареек или аккумуляторов, то этим должны заниматься специальные организации или предприятия. В крупных городах можно найти специально организованные приёмные пункты, куда можно сдать использованные батарейки для их дальнейшей утилизации. Правда, не в каждом городе такой пункт приёма организован. Вопрос, что делать в этом случае остаётся открытым.
- А. Вольта. “Об электричестве, возбуждаемом простым соприкосновением различных проводящих веществ”.
- Радовский М.И. “Гальвани и Вольта”.
- Спасский Б.И. “История физики”.
- Свободная электронная энциклопедия Википедия, раздел “Химический источник тока”.
- Свободная электронная энциклопедия Википедия, раздел “Типоразмеры гальванических элементов”.
Что общего у смартфона, ноутбука, ручного фонарика, интерактивных движущихся игрушек для детей и часов? Ответ прост – батарейка. Именно благодаря незаметным кружочкам, цилиндрам и прямоугольникам мы можем пользоваться всем этим.
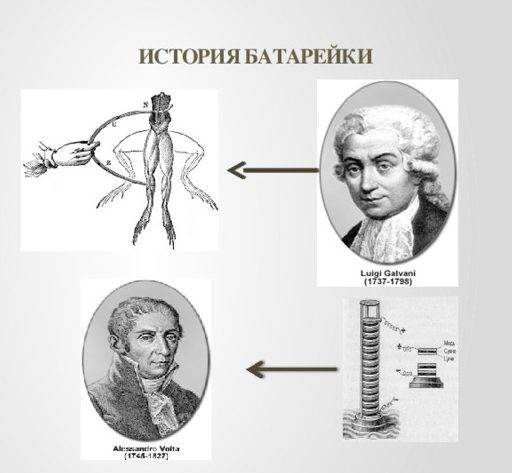
Сколько лет прошло с изобретения батарейки? Большинство скажет, что первые варианты появились в конце XVIII века. Вполне разумно, ведь в 1798 году итальянский граф Алессандро Вольта построил первую примитивную батарейку, получившую имя «Вольтов столб». Он сложил цинковые и медные диски и разделил их полотном, пропитанным щелочью или кислотой. Такая «башня» была высотой в полметра. Но! Существуют свидетельства того, что происхождение батарейки более давнее. Самый первый примитивный образец был известен людям еще за 2000 лет до этого.
В середине XX века (1938 год) на раскопках в Ираке Вильгельм Кениг нашел глиняный горшок 13 см в высоту с медным цилиндром, в который был вставлен стержень из другого металла. Археологи предположили, что это самая древняя батарейка.
Однако как именно использовали этот кувшин жители древнего Ирака, мы уже не узнаем. А вот об итальянце Луиджи Гальвани и животном электричестве известно много. Он заметил, что тело лягушки дергалось, если соприкасалось с двумя металлическими элементами или располагалось рядом с электрической машиной и вылетающими из нее искрами. Луиджи предположил, что электричество есть в самом теле животного.
Именно его опыты с лягушачьими лапками подвигли Вольта на поиск источника электрического тока. Он провел серию испытаний и заметил, что если тело животного соприкасалось с предметами из одного и того же металла, то ничего не происходило, а вот если металлы были разные, то появлялся нужный эффект. Соорудив свою башню из металлических пластин, он доказал, что электрический ток появляется не в тканях животных. Опыты показывали, что причиной всему являются химические реакции между разными металлами соединенными проводником (у Гальвани в его качестве было тело лягушки).
Оба итальянца прославились, а их именами назвали единицу измерения напряжения Вольт и непосредственно сам «гальванический элемент».
Особенности химического состава
В зависимости от веществ, которые используют внутри батареи, такие изделия могут быть солевыми, щелочными или литиевыми. Каждая группа имеет свои особенности химического состава.
Солевой
В качестве катода в солевой батарее используется цинк, а анод представляет собой стержень, изготовленный из графита и MnO2. Электролит в элементе этого типа – это хлорид аммония или калия. Для придания необходимой консистенции в него также добавляют специальный загуститель.
Элементы питания этого типа, в которых в качестве анода используются серебро, обладают значительно большим сроком годности. Называются такие элементы серебряно-цинковыми и стоят значительно дороже простых солевых батареек.
Щелочной
Строение алкалиновой батарейки практически не отличается от солевой. Разница заключается только в том, что в щелочном элементе серединный стержень устанавливается на отрицательный вывод, а не на положительный.
Химический состав изделия этого типа следующий:
- Катод – диоксид марганца.
- Анод – порошкообразный цинк.
- Электролит – гидрооксид калия.
Основное преимущество марганцево-щелочных элементов перед солевыми батареями заключается в большей ёмкости.
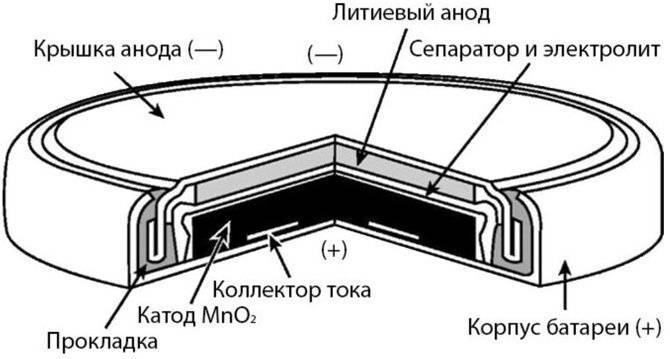
Литиевой
Литиевые неперезаряжаемые элементы имеют следующий химический состав:
- Анод – литий или литиевые соединения.
- Катод – диоксид марганца, пирит и другие.
- Электролит – перхлорат лития, тионилхлорид.
Литиевые элементы питания работает в различных устройствах значительно дольше щелочных и солевых изделий, но и стоимость их на порядок выше.
Принцип работы батарейки

Как работает батарейка
Положительно заряженные частицы двигаются к отрицательным. Средой, где происходит данное движение, является электролит. Заряженные частицы образуются в процессе взаимодействия разных веществ. Весь принцип работы батарейки сводится к химической реакции.
Для прибора необходима нагрузка в виде лампочки или диода, в противном случае при контакте «плюса» и «минуса» может произойти короткое замыкание.
При работе элемента аноды окисляются и разрушаются. Со временем изделие теряет заряд и требует замены. Попытки восстановить его ни к чему хорошему не приведут, т.к. изменения, происходящие в батарее, необратимы.
Если попытаться зарядить конструкцию, то это приведет к взрыву или течи. Но ученым путем проб и ошибок удалось создать восполняемую батарею — аккумулятор.
Недостатками солевых батареек являются:
- Малый срок хранения, не более 2-х лет.
- Резкое падение свойств при снижении температуры.
- Резкое уменьшение емкости при повышении рабочего тока до эксплуатационных значений современных потребителей.
- Быстрое уменьшение напряжения во время работы.
Солевые гальванические элементы в конце своего разряда могут потечь, что связано с вытеканием электролита из-за увеличения объема положительного электрода, который выдавливает электролит. Активная масса плюсового электрода состоит из диоксида марганца и электролита. Сажа и графит, добавленный в активную смесь, повышают электропроводность активной смеси.
Их доля равна от 8 до 20% в зависимости от марки батарейки. Для увеличения срока работы окислителя активную смесь насыщают электролитом.
Минусовой электрод изготавливают из очищенного цинка, устойчивого к коррозии. В нем остается небольшая доля кадмия или свинца, являющегося ингибиторами коррозии. Раньше в батарейках в качестве электролита использовали хлорид аммония.
Важно
Он участвует в реакции образования тока, создает проходимость ионов. Но такой электролит не показал хороших результатов, и его заменили хлоридом цинка с примесями хлорида кальция.
Марганцево-кислые элементы работают дольше, и показывают лучшие результаты при пониженных температурах.
В солевых гальванических элементах отрицательным полюсом является цинковый корпус 7. Плюсовой электрод 6 изготовлен из активной прессованной массы, пропитанной электролитом. По центру этой массы находится угольный стержень 5, обработанный парафином для удержания влаги в электролите.
Верхняя часть стержня закрыта металлическим колпаком. В сепараторе 4 находится густой электролит. В газовую камеру 1 поступают газы, образованные при работе батарейки. Сверху батарейку закрывают прокладкой 3.
Весь гальванический элемент заключают в футляр 2, выполненный из картона или фольги.
Как работает батарейка
Рассмотрим как работает электрическая батарейка и какие реакции взаимодействия происходят между ее химическими компонентами:
- Отрицательно заряженные ионы гидроксида (2OH-) взаимодействуют с цинком (Zn) в анодной секции. В результате химической реакции окисления получается гидроксид цинка (Zn(OH)2) и высвобождаются молекула воды и отрицательно заряженные электроны. Эти электроны теперь свободны для перемещения, и они собираются на латунном штыре (токоотводе отрицательного электрода).
- В то же время диоксида марганца (2MnO2) соединяется с молекулой воды (H2O) из электролита, а также со свободным электроном. Во время такой химической реакции восстановления диоксид марганца превращается в оксид марганца (Mn2O3). Оксид марганца больше не нуждается в атоме гидроксид-иона, поэтому он будет выбрасывать его в электролит.
- Таким образом, появляется скопление электронов на отрицательном конце батарейки. Поскольку больше отрицательно заряженных электронов на отрицательном полюсе по сравнению с положительным, образуется разность напряжений между ними, и эту разность можно измерить с помощью мультиметра.
- Электроны отталкиваются друг от друга и хотят переместиться в область с меньшим количеством электронов. Но сепаратор не позволяет им течь внутри батареи, чтобы достичь положительной клеммы. Если обеспечить электронам внешний путь (например подключив лампочку), то электроны будут течь через него и выполнять работу (заставлять лампу светится).
Наглядно понять, как работает батарейка и что у нее происходит внутри, можно, ознакомившись с представленной ниже видео демонстрацией.
Анатомия батарейки
Как же выглядели первые “батарейки”? Собственно, устройство своего изобретения А. Вольта весьма и весьма подробно описал в своём письме сэру Джозефу Бэнксу. Первый же его опыт выглядел следующим образом: Вольта опустил в банку с кислотой медную и цинковую пластинки, а затем соединил их проволокой. После этого цинковая пластина начала растворяться, а на медной стали выделяться пузырьки газа. “Вольтов столб” – это, можно сказать, стопка из соединённых между собой пластинок цинка, меди и сукна, пропитанных кислотой и сложенных друг на друга в определённом порядке.
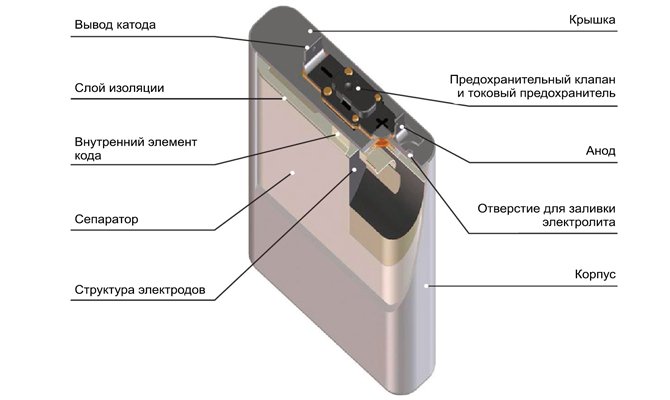
В современных “пальчиковых” и прочих батарейках “начинка” несколько сложнее. В корпусе батарейки упакованы химические реагенты, при взаимодействии которых и выделяется энергия, а также два электрода – анод и катод. Реагенты эти разделены специальной прокладкой, которая не позволяет твердым частям реагентов перемешиваться, но при этом пропускает к ним жидкий электролит.
Жидкий электролит реагирует с твёрдым реагентом, в результате чего возникает заряд. На реагенте анода он отрицательный, а на катодном – положительный. Чтобы не произошло нейтрализации зарядов твёрдые части реагента разделены мембраной.
Чтобы можно было “снять” полученный заряд и передать его на контакты, в анодный реагент вставлен токосниматель, который выглядит очень просто – тоненький не очень длинный штырёк. Есть в батарейке и катодный токосниматель, который располагается под оболочкой батарейки. Саму оболочку называют внешней гильзой.
Оба токоснимателя соприкасаются внутри батарейки с анодом и катодом. Схема работы батарейки в результате такова: химическая реакция, разделение зарядов на реактивах, переход зарядов на токосниматели, далее – на электроды и в питаемое устройство.
Массовое производство батареек
К концу 19 столетия в 1896 году свет увидела первая батарейка сухого типа с углеродом марки Columbia. Американская компания, выпустившая уникальный на то время продукт, в дальнейшем называлась Eveready Battery Company. В наши дни – это известный на весь мир бренд Energizer. Спустя почти столетие, в 1992 году компания Energizer показала миру литиевые батарейки, по долговечности не имеющая равных, предназначена для высокотехнологичного оборудования.
Фабрика Шмидта запустила массовое производство аккумуляторов и батареек в 1903 году под брендом Daimon.
Батареи-таблетки изобретены в 40-е годы 20 века Самюэлем Рубеном для американских военных. Ртутно-цинковый состав и крепкий металлический корпус не боялся мороза, и батарейка бесперебойно работала. Напряжение в компактной батарее –от 1,3 В до 3,5 В. Рубен стал основателем завода батареек одной из узнаваемых марок современности Duracell.
Целью научных изысканий в создании батарейки было улучшение ее свойств, эффективного применения, и создание минимального размера.
Примерно в 1800 году итальянский физик Алессандро Вольта изобрёл батарейку, которой мы и по сей день продолжаем пользоваться. Кстати, кто не знает что такое батарейка, так это источник питания, который вырабатывает электричество под действием химического процесса. То есть батарейка это гальванический элемент, работающий на химической реакции. Так можно объяснить и детям.
Начинка батареек
Солевые
Солевые батарейки наиболее дёшевы, но не держат большую нагрузку, долго не хранятся и имеют свойство «вытекать» при каждом удобном случае.
Упрощённо, солевые батарейки состоят из двух электродов — из цинка и из диоксида марганца. Пространство между электродами заполнено электролитом (его в батарейках называют агломератом), в котором кроме собственно жидкости взвешена сажа и графит — токопроводящие частицы.
Солевые батарейки хранятся максимум 2-3 года, причём падение ёмкости к окончанию срока хранения составляет 30-40 %.
Алкалиновые
Алкалиновые или щелочные батарейки гораздо меньше проседают под высокой нагрузкой, почти не вытекают и практически не подвержены внезапным разогревам при перегрузке.
Химически алкалиновая батарейка состоит ровно из тех же компонентов, но как бы вывернута наизнанку. Агломерат специально загущен, в цинк добавлены висмут и алюминий для увеличения токоотдачи.
Кстати, раньше добавляли вредную ртуть, но все производители давно от неё отказались. До сих пор на многих батарейках можно встретить надпись 0 % Mercury .
Алкалиновая батарейка имеет изоляцию электродов, специальную камеру для газов, а также мембрану. В случае перегрузки и резкого выделения большого количества газов, батарейка не взорвётся, а просто порвётся мембрана. Да, электролит при этом вытечет, но это будет опасно только для устройства, но не для человека.
Как работает батарейка
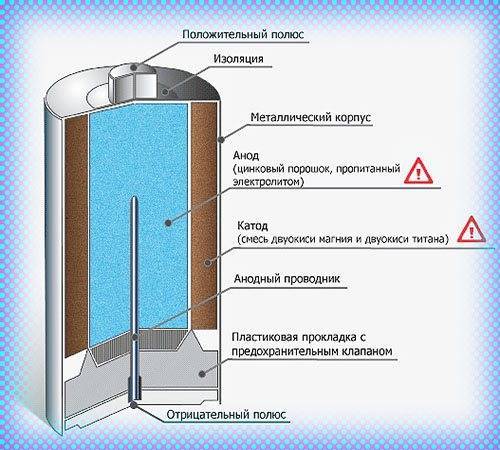
Сегодня в магазинах можно увидеть большое количество батареек, они различны по некоторым принципам, но схема работы у них одна. У любой батарейки есть положительный полюс (анод–цинк Zn), отрицательный полюс (катод–марганец Mg) и электролит (может быть сухим, жидким). Именно эти составляющие и являются основными элементами батарейки. Электрический ток бежит от анода (+) к катоду (—), но между ними обязательно должна быть нагрузка (лампочка, диод, двигатель или что-то ещё). Если нагрузки не будет (соединить «–» с «+» напрямую), то произойдёт короткое замыкание (К.З.) Катоды выполняют функцию восстановителя, т.е. принимают электроны от прибывшего анода. Электролит это среда, в которой перемещаются ионы, которые образуются в процессе химической реакции. В процессе работы батарейки постепенно образовываются новые вещества, а электроды постепенно разрушаются — батарейка садится.
Вот и вся работа батарейки, кстати, все процессы, проходящие в гальваническом элементе, необратимы, то есть заряжать батарейки нельзя. Кратко говоря о работе батарейки: анод — нагрузка — катод — электролит.
Электролит изначально изготовляли в жидком виде, но это неудобно, так как при переворачивании батарейки она просто не работала. Из-за этого электролит стали загущать, превращать его в сухой вид.
Обратная реакция
Все типы батареек и элементов имеют сходный тип химической реакции, происходящей для выработки электроэнергии.
Но в некоторых типах элементов или батарей химические вещества различны, и реакция может быть обратной. Таким образом, элементы могут быть перезаряжены — так же, как литий-ионные аккумуляторы в автомобилях или смартфонах.

Раньше было гораздо дешевле производить неперезаряжаемые элементы, такие как щелочные элементы, поэтому они использовались очень широко.
Но теперь, когда люди осознали, насколько вредно для окружающей среды просто выбрасывать неперезаряжаемые элементы, а поскольку перезаряжаемые элементы становятся дешевле, мы, вероятно, будем использовать неперезаряжаемые элементы все меньше и меньше в будущем.
Виды батареек по химическому составу
В быту «батарейками» называют гальванические элементы, которые создают электрический ток за счет химической реакции. Гальванические элементы производят электрическую энергию благодаря реакциям между двумя металлами в растворе электролита. Один металл является «минусом», другой «плюсом». Между ними протекает реакция окисления (на «минусе») и восстановления (на «плюсе»), за счет которой и возникает ток.
Традиционно с химической точки зрения батарейки разделяют на виды в зависимости от того, какие металлы или какой тип электролита в них используется.
Солевые батарейки
Это старейший тип батареек, разработанный компанией Eveready еще в 20-х годах прошлого века. В качестве «минуса» в нем используется цинк, а в качестве «плюса» — двуокись марганца. Электролит, который обеспечивает протекание реакции — хлорид аммония. Это соль, поэтому батарейка называется солевой.
Солевые батарейки имеют международную маркировку R. Такие батарейки подходят для устройств, не требующих большой мощности питания: детских игрушек, пультов ДУ для телевизоров, часов, ручных фонариков, небольших радиоприемников.
Преимущества
дешевизна маленький вес возможность возобновить работу батарейки после разряда
Недостатки
невысокая выработка токане работают при минусовых температурахнебольшой срок храненияпроблемы с герметичностьюи быстрая разрядка при неиспользовании
Щелочные батарейки
Щелочные батарейки также называются алкалиновыми (от французского alcaline — щелочной). Они также состоят из марганца и цинка, но в качестве электролита, в котором протекает реакция, в них используется гидроксид калия. Это щелочь, поэтому у батарейки такое название.
Щелочная батарейка маркируется буквами LR. Эти батарейки подходят для устройств со средним и высоким потреблением тока, таких как ручные прожекторы, плееры и диктофоны, фотоаппараты.
Преимущества
большая емкость, чем у солевых могут работать при низких температурах герметичны малая скорость саморазряда — могут храниться до 7 лет
Недостатки
цена чуть вышеболее тяжелый весодноразовые — после выработки заряда использоваться больше не могут
Ртутные батарейки
В этих батарейках в качестве «минуса» служит цинк, а «плюса» — оксид ртути. Они разделяются слоем электролита, в роли которого выступает 45% раствор щелочи (гидроксид калия, как и в алкалиновых).
Ртутные батарейки в наше время используются очень редко из-за общеизвестного факта: ртуть токсична. Однако еще в недалеком прошлом они активно применялись в электронных часах, весах, медицинской технике — слуховых аппаратах, кардиостимуляторах.
Преимущества
стабильность напряжения большая ёмкость высокая энергоплотность стойкость к перепаду температур долгое время хранения
Недостатки
ядовитость ртути при нарушении герметичностидороговизнасложность утилизации
Серебряные батарейки
Есть и такие. В них роль «минуса» опять играет цинк, а роль «плюса» — оксид серебра. Реакция с выделением электрического тока протекает при помощи щелочного электролита — гидроксида калия или натрия.
Международная маркировка серебряной батарейки — SR. Используются они в тех же сферах, что и ртутные, и по достоинствам и недостаткам практически им аналогичны. Главное преимущество серебряных батареек перед ртутными — безопасность: серебро нетоксично, и при нарушении герметичности корпуса нет риска отравления. Главный минус — серебряные батарейки дороже всех остальных видов батареек.
Литиевые батарейки
Наконец, последний тип батареек — литиевый. У этих батареек в качестве «плюса» используется литий, а вот «минус» и электролит могут быть представлены различными веществами: диоксид марганца, монофторид углерода, пирит, тионилхлорид и другие.
Литиевые батарейки могут использоваться в разной портативной электронике и имеют маркировку CR. Они объединяют в себе все преимущества предыдущих типов и, по факту, являются самым хорошим гальваническим элементом питания. Но по сравнению с щелочными и солевыми элементами литиевые батарейки дороговаты (хотя в зависимости от используемых веществ цена может сильно различаться). Поэтому первые тоже выпускаются в большем количестве для бюджетного сегмента.
Преимущества
легкость долгое время хранения (до 12 лет) термическая стойкость стабильное напряжение высокая энергоплотность и энергоемкость
Недостатки
высокая стоимость
Как видите, литиевые батарейки — это единственный тип, у которого достоинства решительно перевешивают недостатки. Поэтому рекомендуем попробовать: