Как работают химические элементы питания, из чего они сделаны, и какие мифы о них существуют
Опубликовано 17.10.2013 // 0 Комментарии
Где бы вы ни были и куда бы ни пошли, вы, так или иначе, столкнетесь с батарейками или аккумуляторами. Попробуйте представить мир, в котором бы все электроприборы питались от розеток – никаких телефонов, фонариков, ноутбуков, автомобилей и прочих уже привычных благ цивилизации. Аккумуляторы повсюду: от мобильных телефонов до космических кораблей. О том, как работают эти портативные источники энергии, из чего они сделаны, и какие мифы о них правдивы, а какие – нет, мы попытаемся разобраться в этой статье.
Первые батарейки
Однако первые современные батарейки появились в 1800 году благодаря итальянскому ученому Алессандро Вольте, который получил непрерывный электрический ток, поместив цинковые и медные пластины в кислоту. Это изобретение получило название Вольтов столб, а единица измерения напряжения получила название в честь его создателя. С тех пор появились новые виды батареек с усовершенствованной конструкцией и улучшенным коэффициентом полезного действия, но принцип их работы существенно не изменился: при подключении батарейки к устройству в ней происходит электрохимическая реакция и вырабатывается электричество.
По типу электрохимической реакции различают два типа химических источников питания: 1. Гальванические элементы (батарейки). Они отличаются необратимой реакцией при выработке электроэнергии, поэтому их нельзя перезарядить. Попытка перезарядить батарейку может привести к утечке щелочи или другого вещества, в зависимости от батарейки. 2. Аккумуляторы. Они отличаются обратимостью реакций при выработке электричества, поэтому их можно перезарядить. Аккумуляторы могут не только, как батарейки, преобразовывать химическую энергию в электрическую, но и наоборот.
Как работают батарейки
Оригинал: Microsoft Encarta
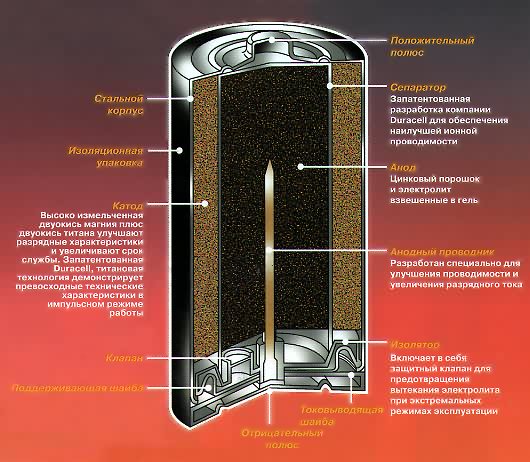
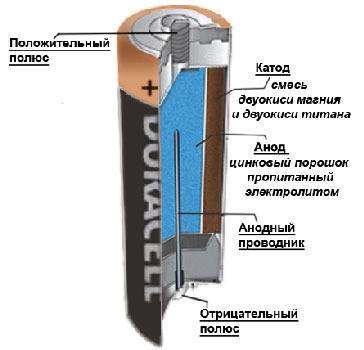
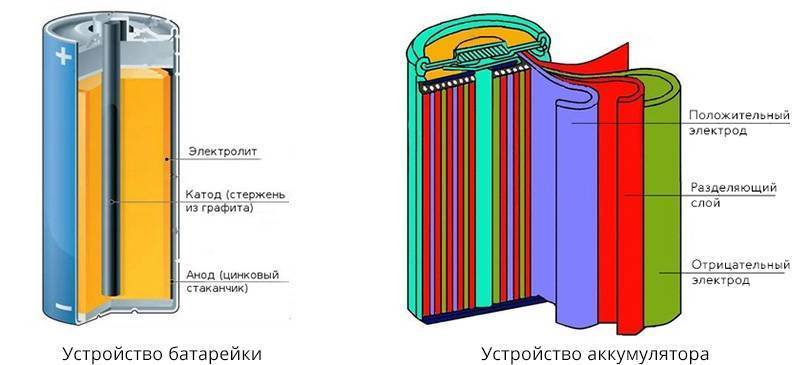
Главными компонентами батарейки, из которых она состоит на 90 %, являются электролит и два электрода: анод, подключенный к отрицательному полюсу (-) и катод, подключенный к положительному полюсу (+). Если подключить батарейку к электрической цепи, в ней начнут происходить окислительно-восстановительные процессы. Взаимодействуя с электролитом, материал анода начнет окисляться и выделять отрицательно заряженные частицы – электроны, – которые и образуют электрический ток. Во время работы батарейки в аноде (-) вырабатывается избыточное количество электронов, и единственным выходом для них является перемещение к положительному полюсу. Взаимодействуя с материалом катода, электроны нейтрализуются в результате реакции восстановления. Именно избыток электронов в отрицательном полюсе и их нехватка в положительном полюсе приводит к постоянному перераспределению электронов между полюсами и создает электрическое напряжение. Окислительно-восстановительные процессы протекают в батарейке постоянно, пока она подключена к электрической цепи, изменяя изначальный состав материалов анода и катода: образуются второстепенные элементы, которые препятствуют движению электронов. Это приводит батарейку в негодность.
Аккумуляторы
Аккумуляторы отличаются от батареек обратимостью химических процессов, проще говоря, возможностью перезарядки. В электрической цепи аккумулятор работает так же, как и батарейка: в аноде образуются электроны, которые перемещаются в катод, образуя электрическое напряжение. Когда материал анода истощается, электроны прекращают вырабатываться и аккумулятор садится. Вот здесь и кроется главное преимущество аккумуляторы: в отличие от батарейки, анод можно восстановить, пропустив через аккумулятор электрический ток. Естественно, это не значит, что аккумуляторы будут работать вечно, ведь материал анода в любом случае будет постепенно истощаться, но на сотню перезарядок обычного аккумулятора зачастую хватает.
В зависимости от материалов, используемых в качестве анода и катода, выделяют разные типы батареек. Каждый тип отличается производительностью, сроком эксплуатации, ценой и вредностью. К сожалению, не существует идеальных батареек, которые бы удовлетворяли пользователей всеми параметрами. О типах батареек и аккумуляторов, их преимуществах и недостатках читайте далее.
Виды батареек по химическому составу
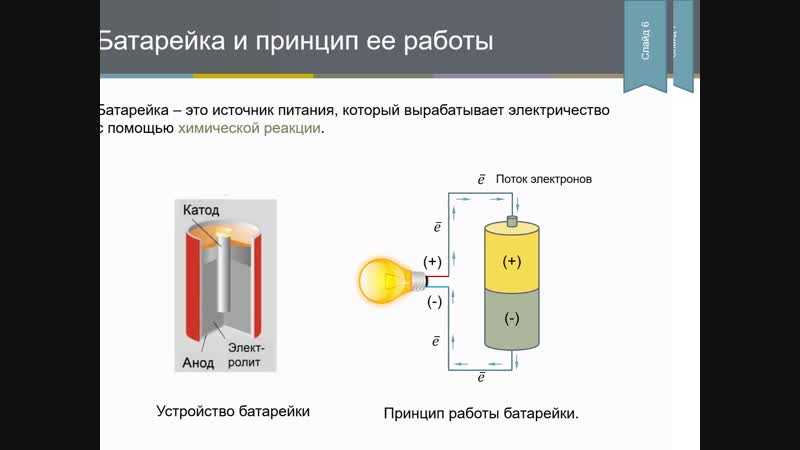
В быту «батарейками» называют гальванические элементы, которые создают электрический ток за счет химической реакции. Гальванические элементы производят электрическую энергию благодаря реакциям между двумя металлами в растворе электролита. Один металл является «минусом», другой «плюсом». Между ними протекает реакция окисления (на «минусе») и восстановления (на «плюсе»), за счет которой и возникает ток.
Традиционно с химической точки зрения батарейки разделяют на виды в зависимости от того, какие металлы или какой тип электролита в них используется.
Солевые батарейки
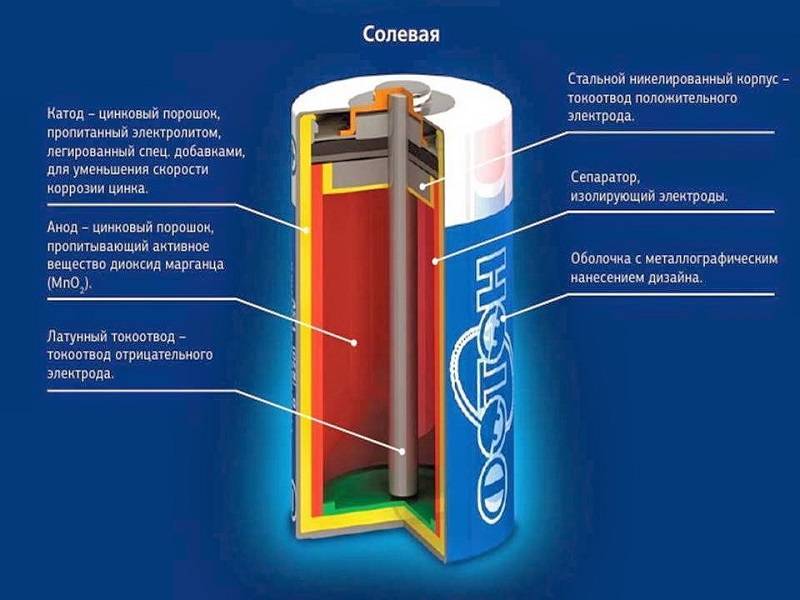
Это старейший тип батареек, разработанный компанией Eveready еще в 20-х годах прошлого века. В качестве «минуса» в нем используется цинк, а в качестве «плюса» — двуокись марганца. Электролит, который обеспечивает протекание реакции — хлорид аммония. Это соль, поэтому батарейка называется солевой.

Солевые батарейки имеют международную маркировку R. Такие батарейки подходят для устройств, не требующих большой мощности питания: детских игрушек, пультов ДУ для телевизоров, часов, ручных фонариков, небольших радиоприемников.
Преимущества
дешевизна маленький вес возможность возобновить работу батарейки после разряда
Недостатки
невысокая выработка тока не работают при минусовых температурах небольшой срок хранения проблемы с герметичностью и быстрая разрядка при неиспользовании
Щелочные батарейки
Щелочные батарейки также называются алкалиновыми (от французского alcaline — щелочной). Они также состоят из марганца и цинка, но в качестве электролита, в котором протекает реакция, в них используется гидроксид калия. Это щелочь, поэтому у батарейки такое название.
Щелочная батарейка маркируется буквами LR. Эти батарейки подходят для устройств со средним и высоким потреблением тока, таких как ручные прожекторы, плееры и диктофоны, фотоаппараты.
Преимущества
большая емкость, чем у солевых могут работать при низких температурах герметичны малая скорость саморазряда — могут храниться до 7 лет
Недостатки
цена чуть выше более тяжелый вес одноразовые — после выработки заряда использоваться больше не могут
Ртутные батарейки
В этих батарейках в качестве «минуса» служит цинк, а «плюса» — оксид ртути. Они разделяются слоем электролита, в роли которого выступает 45% раствор щелочи (гидроксид калия, как и в алкалиновых).
Ртутные батарейки в наше время используются очень редко из-за общеизвестного факта: ртуть токсична. Однако еще в недалеком прошлом они активно применялись в электронных часах, весах, медицинской технике — слуховых аппаратах, кардиостимуляторах.
Преимущества
стабильность напряжения большая ёмкость высокая энергоплотность стойкость к перепаду температур долгое время хранения
Недостатки
ядовитость ртути при нарушении герметичности дороговизна сложность утилизации
Серебряные батарейки
Есть и такие. В них роль «минуса» опять играет цинк, а роль «плюса» — оксид серебра. Реакция с выделением электрического тока протекает при помощи щелочного электролита — гидроксида калия или натрия.

Международная маркировка серебряной батарейки — SR. Используются они в тех же сферах, что и ртутные, и по достоинствам и недостаткам практически им аналогичны. Главное преимущество серебряных батареек перед ртутными — безопасность: серебро нетоксично, и при нарушении герметичности корпуса нет риска отравления. Главный минус — серебряные батарейки дороже всех остальных видов батареек.
Литиевые батарейки
Наконец, последний тип батареек — литиевый. У этих батареек в качестве «плюса» используется литий, а вот «минус» и электролит могут быть представлены различными веществами: диоксид марганца, монофторид углерода, пирит, тионилхлорид и другие.

Литиевые батарейки могут использоваться в разной портативной электронике и имеют маркировку CR. Они объединяют в себе все преимущества предыдущих типов и, по факту, являются самым хорошим гальваническим элементом питания. Но по сравнению с щелочными и солевыми элементами литиевые батарейки дороговаты (хотя в зависимости от используемых веществ цена может сильно различаться). Поэтому первые тоже выпускаются в большем количестве для бюджетного сегмента.
Преимущества
легкость долгое время хранения (до 12 лет) термическая стойкость стабильное напряжение высокая энергоплотность и энергоемкость
Недостатки
высокая стоимость Как видите, литиевые батарейки — это единственный тип, у которого достоинства решительно перевешивают недостатки. Поэтому рекомендуем попробовать:
Кто изобрел батарейку?
Если верить археологам, то первые батарейки появились еще 2000 лет назад. Во время раскопок в Ираке нашли глиняную вазу, залитую битумом, в который были вделаны медный и железный стержень. Действительно ли это использовалось в качестве источника электричества, трудно сказать – это всего лишь предположения.
Первой современной батарейкой по праву можно назвать “Вольтов столб” – устройство, созданное итальянским физиком Алессандро Вольта в 1800 году.
 |
| Алессандро Вольта |
“Вольтов столб” представлял собой стопку из пластин разных металлов – цинковых и медных. Между ними клалась ткань, смоченная в кислоте. Химическая реакция между элементами “Вольтова столба” создавала электричество.
| Вольтов столб |
Его работа основывалась на предположениях Луиджи Гальвани, который проводил опыты с лягушкой, подводя к ее лапке металлические полоски.
 |
| Луиджи Гальвани |
Однако, Л. Гальвани сделал неправильные выводы, решив, что само животное обладает электричеством, назвав это “животным электричеством”. А. Вольта правильно понял, что разряд возникал из-за того, что лапка, находившаяся между двумя полосками металла, была влажной и служила в качестве проводника.
По имени Л. Гальвани “Вольтов столб” и другие источники электричества подобного типа получили название “Элемента Гальвани” или “Гальванического элемента”. Это, на самом деле, более правильное название для таких устройств, так как батарейка – это батарея, т.е. серия гальванических элементов, соединенных между собой. А единицу напряжения, которую давал гальванический элемент, назвали “вольтом” в честь Алессандро Вольта.
Что внутри батарейки?
Ниже будет рассмотрено строение четырех типов источников питания. По сути принцип работы один и тот же, но состоят эти энергетические накопители из разных составляющих.
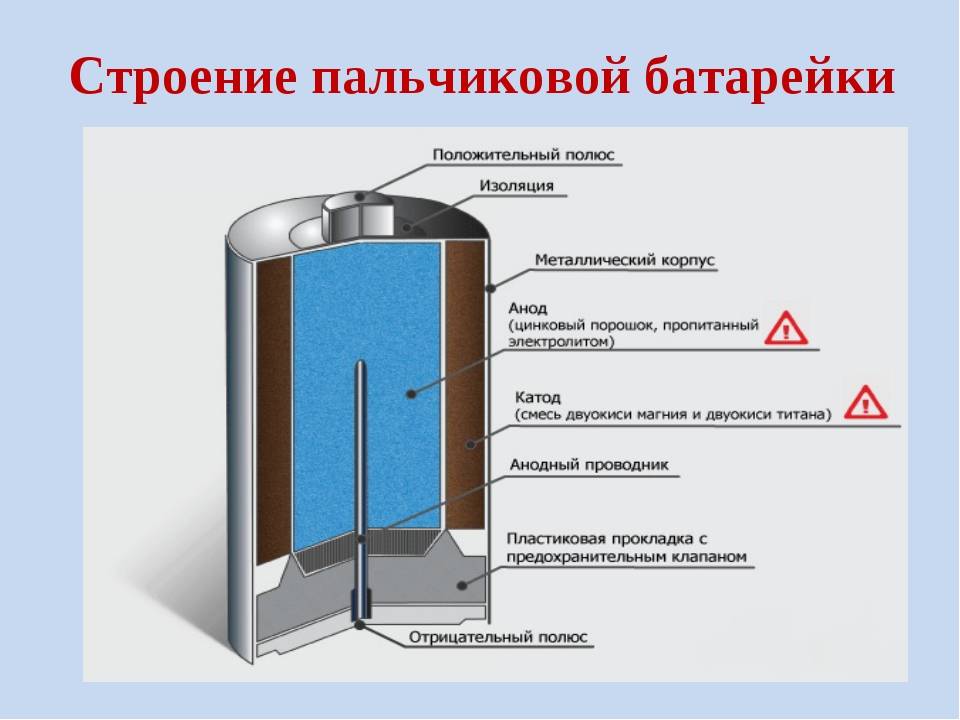
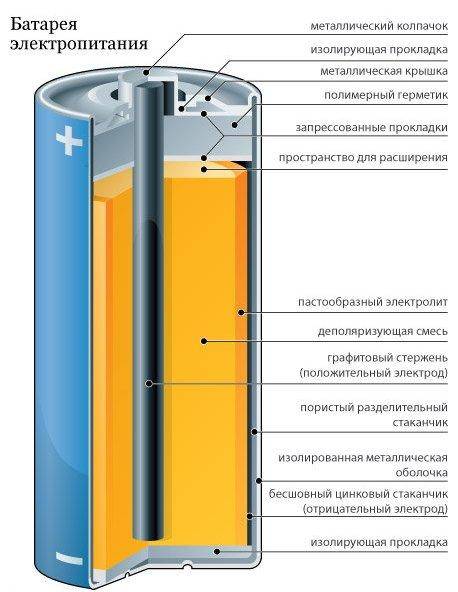
Состав пальчиковой батарейки
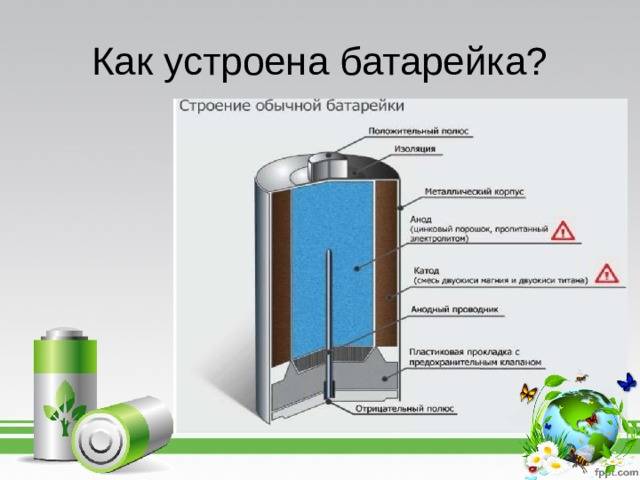
В состав батареи входят следующие элементы:
- Катод – это отрицательный полюс
- Вкладыш служит некой прокладкой
- Диафрагма
- Футляр
- Электролит – жидкость вследствие которой идет химическая реакция
- Стержень сделанный из угля
- Крепежная шайба
- Анод или положительный полюс

Примерно так выглядит состав батареек пальчиковых. Но иногда их устройство бывает иным. Например, в строение может быть использован лишь угольный стержень, специальный темный порошок и металлические элементы.
Устройство круглой батарейки
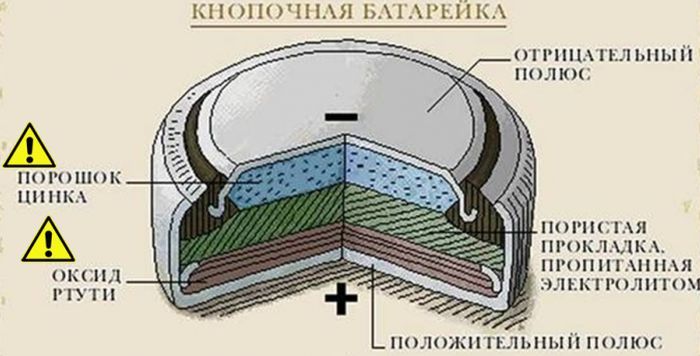
Приплюснутый элемент питания имеет своеобразную форму. Вот строение батарейки в разрезе:
- Положительный торец
- Отрицательный полюс
- Пористая прокладка, вымоченная в электролите
- Оксид ртути
- Порошок Zn

Устройство батарейки может быть и немного иным:

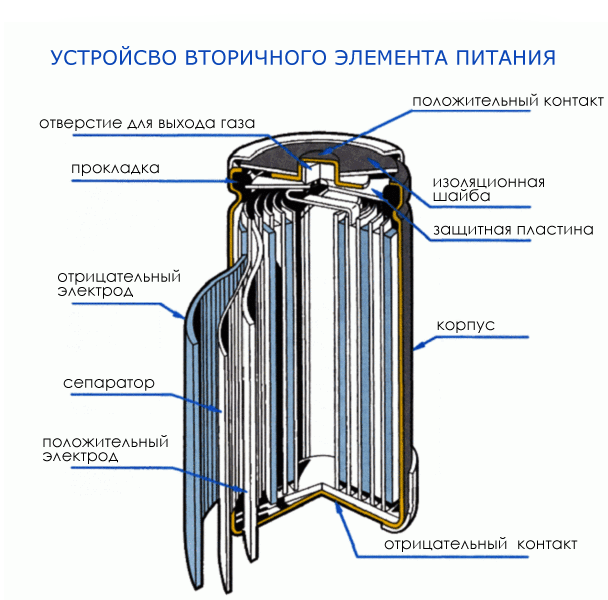
Детали энергетического элемента:

Если сильно нагреть данный эелмент, то под напором внутреннего газа она запросто может взорваться. Таким образом сейчас вы можете созерцать что внутри у батарейки.
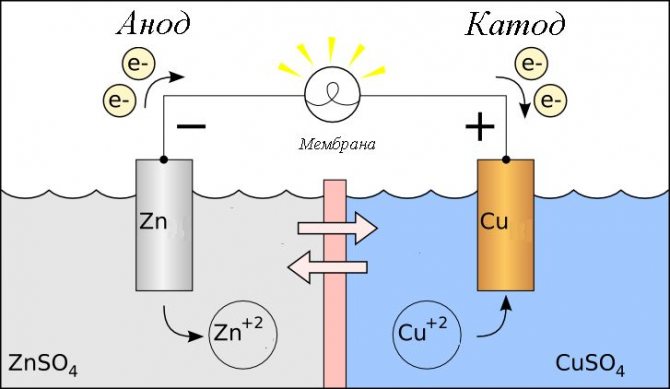
Устройство батареи телефона
Принцип устройства батарейки мобильника:
- Положительный и отрицательный полюс
- Анодный стакан
- Катодный контакт
- Сепаратор
- Уплотнение
- Защитный клапан
- Изолятор
- Колпачок
- Перегородка
- Корпус алюминиевый или иной
Таким образом устройство батарейки мобильного телефона немного сложнее обычного солевого источника питания.

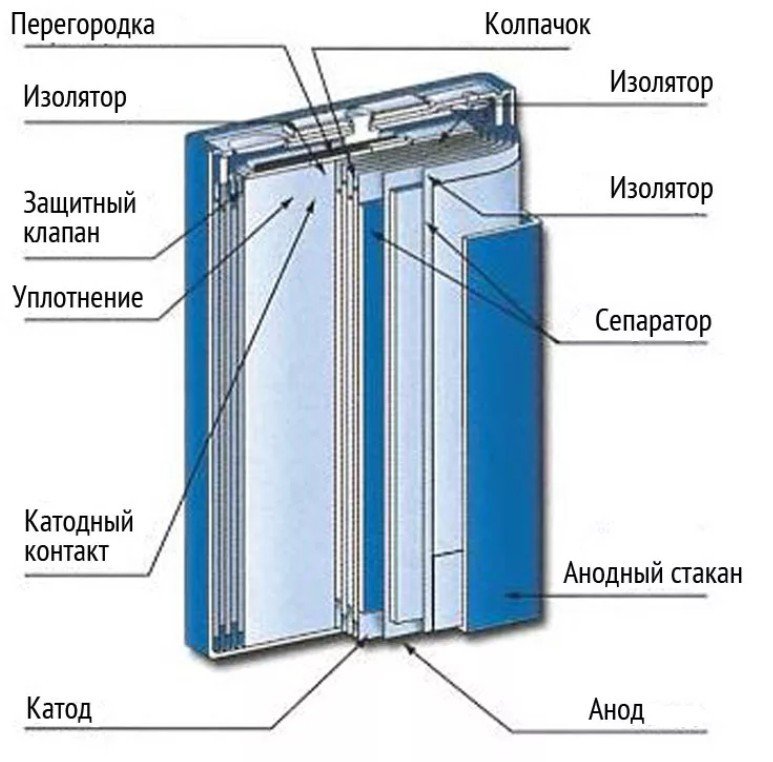
Из чего состоит батарейка Крона?
Данный источник энергии устроен следующим образом. Контакты плюс и минус находятся друг на против друга в верхней части элемента питания. Под ними расположена пластмассовая основа. От отрицательного контакта идет пластина на минусовой полюс. И там она плотно прикрепляется. Состав батарейки схож с выше приведенными источниками питания.
Внутри металлического прямоугольного стаканчика находятся 6-ь закругленных сплющенных прямоугольников. Каждый из которых является отдельной батареей. Размер данных элементов: Длинная: 2,2 см; Ширина 1,5 см; Высота: 0,5 см. Каждый такой бочонок имеет заряд 1,5 вольта. Друг от друга они отделены специальными пластинами. Но все же они соединены между собой в середине. Подобное устройство батарейки экономически выгодно!
Что находится внутри батарейки крона?
Вот собственно батарейка в разрезе. Иногда она может быть такой.


Но обычно можно заметить, что крона выполнена по такому типу как на рисунки ниже.



Ее строение достаточно простое:
- 2 контакта «+» и «-».
- Металлический корпус.
- Нижняя и верхняя пластины, выполненные из пластика.
- Шесть прямоугольников на 1,5 вольта соединенных между собой.
- Электролит.
- Угольный стержень
- Внутренняя пленка.
- Изоляционные пластины.
- Устройство батарейки включает в себя так же обертку.
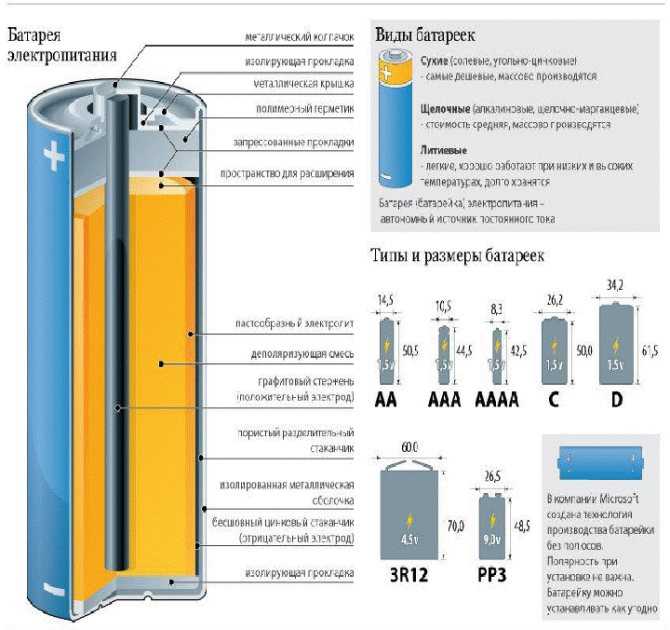
Виды батареек
Классификация батареек по типу химической реакции
| Тип | Описание | Достоинства | Недостатки |
| Первичные | Гальванические элементы. Реакции, происходящие в них, необратимы, поэтому их нельзя перезарядить. | Дешевле стоят, меньше саморазряд. | Одноразовые. |
| Вторичные | Аккумуляторы. Реакции в них обратимы, поэтому они способны не только отдавать энергию, но и накапливать её. | Многократность применения. Более экологичные. | Дороже. Сильнее саморазряд. |
Классификация батареек по типу электролита (список не полный, указаны только самые распространённые в быту)
| Тип | Достоинства | Недостатки | Фото |
| «Солевые» (угольно-цинковые) | Самый дешёвый. Рабочая температура: от −40 до +55 °C (данные Википедии). | Малая емкость, не позволяющая использовать изделия в мощных устройствах, малый срок хранения. | |
| «Щелочные» (алкалиновые, щёлочно-марганцевые) | Ёмкость в 1,5–10 раз больше, чем у солевых элементов, в зависимости от режима работы, при том же типоразмере элемента. Меньший саморазряд, длительный срок хранения. Лучше работают при больших токах нагрузки. Меньше падение напряжения по мере разряда. Меньше газовыделение, благодаря чему элемент можно делать полностью герметичным. Рабочая температура: от -30 до +55 °С. | Спадающая кривая разряда, большая масса. | |
| «Литиевые» | Наивысшая ёмкость на единицу массы. Пологая кривая разряда. Превосходен при низких и высоких температурах (лучше чем у предыдущих элементов). Длительное время хранения. Лёгкий вес. | Высокая цена |
Типы батареек по размеру и их обозначения
Здесь мы разместили таблицу в которой указаны, помимо размеров и характеристик, «название» и «маркировка». По сути это одно и то же, и даже, как правило, на всех элементах указывается одновременно. В США принято буквенное обозначение (в колонке «название»), и оно ориентированно на физический размер «батарейки».
| Название | Фото | Маркировка | Диаметр (мм) | Высота (мм) | Емкость (мАч) |
| A | Солевая (R23) Щелочная (LR23) | 17 | 50 | — | |
| AA | Солевая (R6) Щелочная (LR6) Литиевая (FR6) | 14,5 | 50,5 | 1100-3500 | |
| AAA | Солевая (R6) Щелочная (LR6) Литиевая (FR6) | 10,5 | 44,5 | 540-1300 | |
| AAAA | Щелочная (LR8D425) | 8.3 | 42.5 | 625 | |
| B | Щелочная (LR12 или 3R12) | 22 | 62 × 67 | 8350 | |
| C | Солевая(R14) Щелочная(LR14) | 26.2 | 50 | 3800-8000 | |
| D | Солевая(R20) Щелочная(LR20) | 34.2 | 61.5 | 8000-19500 | |
| F | Солевая(R25) Щелочная(LR25) | 33 | 91 | — | |
| N | Солевая(R1) Щелочная(LR1) | 12 | 30.2 | 1000 | |
| 1/2AA | Солевая (R14250) | 14.5 | 25 | 250 |
* Параметры ёмкости и тока в батарейке могут отличаться в зависимости от производителя.
Маркировки батареек
Маркировку гальванических источников тока делают исходя из состава электролита и активного металла в их конструкции. Регламентирует всё это IEC (Международная электротехническая комиссия). По этой классификации существует 5 самых распространенных типов круглых (цилиндрических) батареек:
солевые, щелочные, литиевые, серебряные и воздушно-цинковые.
Мы рассмотрим первые три, поскольку в предыдущей таблице не стали описывать стандарты для двух последних (серебряных и воздушно-цинковых батареек). Разнообразие этих элементов гораздо шире и мы не уместимся в рамки статьи.
Буква R в их маркировке означает круглую форму (от английского round).
Солевые батарейки (R).
Катод состоит из марганца (MnO2) в смеси с графитом (около 9,5 %), анод из цинка (Zn), и электролит из раствора хлорида аммония NH4Cl. Они обеспечивают напряжение 1,5 вольта, имеют небольшую емкость, высокий саморазряд и низкий срок хранения (примерно 2 года). Солевые батарейки самые дешевые и имеют посредственные технические характеристики. В обиходе их также называют цинк-карбоновыми и угольно-цинковыми. Наиболее эффективной областью применения солевых батареек являются приборы со средним и низким энергопотреблением. Например, пульты ДУ и настенные часы.
Щелочные батарейки (LR).
Имеют катод из диоксида марганца, анод из цинка (порошок), и электролит из гидроксида щелочного металла (обычно гидроксид калия). Они имеют напряжение 1,5 вольта, увеличенную емкость, низкий саморазряд и большой срок хранения до 10 лет. Эти источники тока несколько дороже солевых, в обиходе их еще называют алкалиновыми и щелочно-марганцевыми.
Литиевые батарейки (CR).
Имеют анод из лития, катод чаще из диоксида марганца (но используются и другие составы для катода). Они имеют большую емкость, малый саморазряд и большой срок хранения до 10-12 лет. Они сохраняют работоспособность при низких температурах. Эти источники тока довольно дороги.
Надеемся, что вы нашли ответ на вопрос «что такое батарейка?».
Почему литий-ионные аккумуляторы на 1.5 В лучше аккумуляторов других типов?
Литиевые аккумуляторы на 1.5 В имеют все те же преимущества, которые присущи обычным литиевым батареям. Они имеют небольшой вес, у них практически отсутствует саморазряд и имеется большой запас циклов заряда-разряда. К тому же у них имеется значительно больший запас накопленной энергии в пересчете на тот-же объем вещества аккумуляторов других типов формата АА и ААА. Но тут есть некоторое «НО», о котором речь пойдет дальше.
Литиевые аккумуляторы на 1.5 вольта в своем корпусе содержать не только электроды с электролитом и прочим, но и электронику, из-за которой самого аккумулятора помещается меньше, чем могло бы в корпусе формата АА или ААА. Из-за этого емкость такого аккумулятора не высока, и он может конкурировать по величине емкости разве что с дорогими щелочными батарейками того же формата.

На выходных контактах литий-ионного аккумулятора на 1.5 В всегда выдается стабилизированное напряжение 1.5 вольта, пока он полностью не разрядится. Благодаря этому устройства, в которые он будет установлен, проработают на необходимом им уровне напряжения до полного отключения аккумулятора. В случае же с батарейками или аккумуляторами других типов, напряжение по мере разряда будет уменьшаться. Для некоторых девайсов это будет означать нестабильную работу, а другие будут постоянно оповещать о низком уровне напряжения батареи и в итоге отключатся.

В процессе эксплуатации такой литиевый аккумулятор на 1.5 вольта сможет заменить собой более 1000 дорогих щелочных батареек, что уже достаточно выгодно.
Разница форм и размеров
Первым делом, когда вы достали севшую батарейку из прибора, определите её форму и размер. Элемент питания другого типа не подойдёт к вашему устройству.
Начнём с цилиндрических батареек. Всем знакомые пальчиковые и мизинчиковые элементы — это как раз они. Однако в этой группе существуют и более крупные особи. Начнём с самого популярного вида.
Большинство портативных радиоприёмников, фонариков и других электронных устройств работает от батареек АА (пальчиковые). Их вы найдёте в каждом ларьке. Помимо двух заглавных букв, на них может быть написано R6, LR6 или FR6. Ниже мы объясним этот шифр.
Элементы ААА чуть меньше собрата. В народе их называют «мизинчиковыми». Они встречаются в тех же устройствах, что и батарейки АА, только в более компактных, куда двухбуквенные не помещаются. На них вы увидите такие комбинации символов, как R03, LR03 или FR03.
Батарейки типоразмера C (R14, LR14) по высоте сопоставимы с пальчиковыми и в два раза толще их. Такие элементы используют в более крупной и энергоёмкой технике — переносных магнитофонах, электрических фонарях; как правило, последовательно по несколько штук.
И гигант всех цилиндров — батарейка типа D (R20, LR20) — имеет аналогичные сферы применения.
Первой из нецилиндрических элементов рассмотрим девятивольтовую «Крону». Название происходит от марки батареек, которые выпускались в СССР. Они представляют собой параллелепипеды с двумя разъёмами (полюсами) на одной стороне — гнездом (минус) и штекером (плюс). Кроны распространены в измерительных приборах и автономном медицинском оборудовании. Вы с лёгкостью отличите их от других по форме, а надписи 6LR61 или 6F22 подтвердят это.
Батареи 3R12 и 3LR12 — это массивные элементы питания, которые предназначались для карманных фонарей. Сейчас их используют в самодельных электронных устройствах, где необходимо напряжение 4,5 В.
Ещё одна группа батареек — кнопочные («таблетки»). Они предназначены для устройств, в которые не помещаются элементы другого типоразмера. Это могут быть наручные часы, калькуляторы, небольшая светодиодная техника, электронная сувенирная продукция, гирлянды, слуховые аппараты, лазерные указки.
Батарейка и всё о ней
 Батарейка — это слово плотно вошло в нашу повседневную жизнь. Но, к сожалению, сегодня мало кого интересует её история, устройство, её виды. Давайте вместе разберёмся с этими и другими интересными вопросами о батарейке. А точнее «что такое батарейка», «как работает батарейка». Повседневная жизнь не требует каких-то великих усилий для включения телевизора, калькулятора, для нормальной работы настенных часов, для работы компьютерной мыши и так далее. А все благодаря каким-то батарейкам, которые помогают упростить нашу жизнь, помогают сэкономить наше время. Это понимает каждый здравомыслящий человек, но не каждый задаёт себе вопрос: «как из таких маленьких батареек совершается такой объём работы», «как устроены батарейки»… А, между тем, это физика.
Батарейка — это слово плотно вошло в нашу повседневную жизнь. Но, к сожалению, сегодня мало кого интересует её история, устройство, её виды. Давайте вместе разберёмся с этими и другими интересными вопросами о батарейке. А точнее «что такое батарейка», «как работает батарейка». Повседневная жизнь не требует каких-то великих усилий для включения телевизора, калькулятора, для нормальной работы настенных часов, для работы компьютерной мыши и так далее. А все благодаря каким-то батарейкам, которые помогают упростить нашу жизнь, помогают сэкономить наше время. Это понимает каждый здравомыслящий человек, но не каждый задаёт себе вопрос: «как из таких маленьких батареек совершается такой объём работы», «как устроены батарейки»… А, между тем, это физика.
Самые первые прототипы батареек появились ещё в Месопотамии около 2000 лет назад. Состояла она в то время из глиняной вазы, медного и железного стержней, залитыми битумом. Кстати, если такой сосуд залить кислотой (уксусной, серной), то получим напряжение примерно в 1В. Назвали такой прототип «Багдадской батарейкой » в связи с местом, на котором были обнаружены. Примерно в 1800 году итальянский физик Алессандро Вольта изобрёл батарейку, которой мы и по сей день продолжаем пользоваться. Кстати, кто не знает что такое батарейка, так это источник питания, который вырабатывает электричество под действием химического процесса. То есть батарейка это гальванический элемент, работающий на химической реакции. Так можно объяснить и детям.
____________________________________________
Возможно, вам будет интересно: Почему батарейки кислые на вкус?
__________________________________________________________________
Как работает батарейка
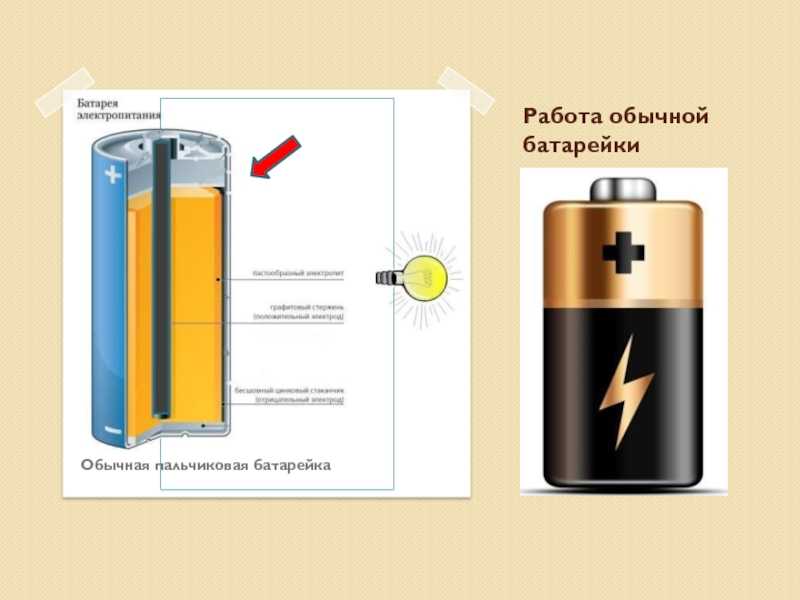
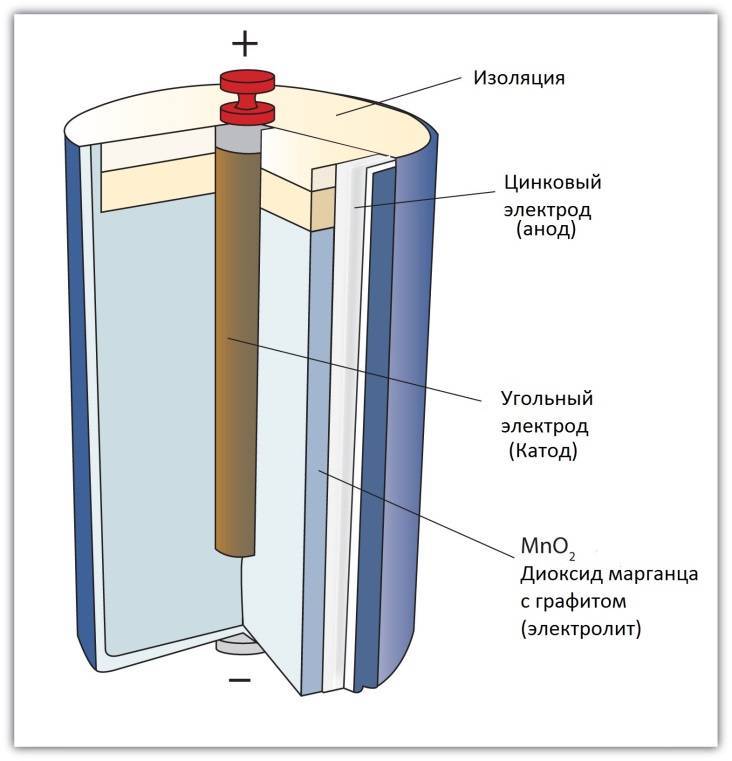
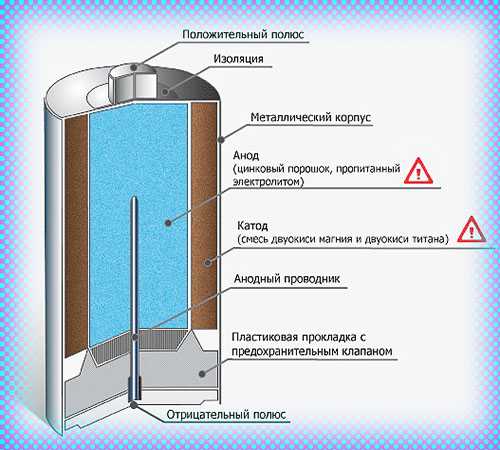 Сегодня в магазинах можно увидеть большое количество батареек, они различны по некоторым принципам, но схема работы у них одна. У любой батарейки есть положительный полюс (анод–цинк Zn), отрицательный полюс (катод–марганец Mg) и электролит (может быть сухим, жидким), именно эти элементы и являются основными элементами батарейки. Электрический ток бежит от анода (+) к катоду (—), но между ними обязательно должна быть нагрузка (лампочка, диод, двигатель или что-то ещё). Если нагрузки не будет (соединить «–» с «+» напрямую), то произойдёт короткое замыкание (К.З.). Катоды выполняют функцию восстановителя, т.е. принимают электроны от прибывшего анода. Электролит это среда, в которой перемещаются ионы, которые образуются в процессе химической реакции. В процессе работы батарейки постепенно образовываются новые вещества, а электроды постепенно разрушаются — батарейка садится. Вот и вся работа батарейки, кстати, все процессы, проходящие в гальваническом элементе, необратимы, то есть заряжать батарейки нельзя. Кратко говоря о работе батарейки: анод — нагрузка — катод — электролит. Электролит изначально изготовляли в жидком виде, но это неудобно, так как при переворачивании батарейки она просто не работала. Из-за этого электролит стали загущать, превращать его в сухой вид.
Сегодня в магазинах можно увидеть большое количество батареек, они различны по некоторым принципам, но схема работы у них одна. У любой батарейки есть положительный полюс (анод–цинк Zn), отрицательный полюс (катод–марганец Mg) и электролит (может быть сухим, жидким), именно эти элементы и являются основными элементами батарейки. Электрический ток бежит от анода (+) к катоду (—), но между ними обязательно должна быть нагрузка (лампочка, диод, двигатель или что-то ещё). Если нагрузки не будет (соединить «–» с «+» напрямую), то произойдёт короткое замыкание (К.З.). Катоды выполняют функцию восстановителя, т.е. принимают электроны от прибывшего анода. Электролит это среда, в которой перемещаются ионы, которые образуются в процессе химической реакции. В процессе работы батарейки постепенно образовываются новые вещества, а электроды постепенно разрушаются — батарейка садится. Вот и вся работа батарейки, кстати, все процессы, проходящие в гальваническом элементе, необратимы, то есть заряжать батарейки нельзя. Кратко говоря о работе батарейки: анод — нагрузка — катод — электролит. Электролит изначально изготовляли в жидком виде, но это неудобно, так как при переворачивании батарейки она просто не работала. Из-за этого электролит стали загущать, превращать его в сухой вид.
Виды батареек
Солевые (угольно-цинковые, марганцево-цинковые) батарейки.
Изготовляются из пассивного угля и двуокиси марганца, электролит из хлорида аммония и катод из цинка. В перерывах работы элементы питания могут восстанавливаться, т.е. выравнивать локальные неоднородности в композите электролита, вызванных разрядом. Такой процесс немного продлевает срок службы батарейки.

Алкалиновые (щёлочные) батарейки
В отличие от солевых батареек у этих химический элемент электролита — щелочной электролит. Щёлочные батарейки (алкалин) имеют продолжительный срок хранения, а в процессе эксплуатации напряжение на электродах меняется гораздо меньше, чем у элементов с солевым раствором.
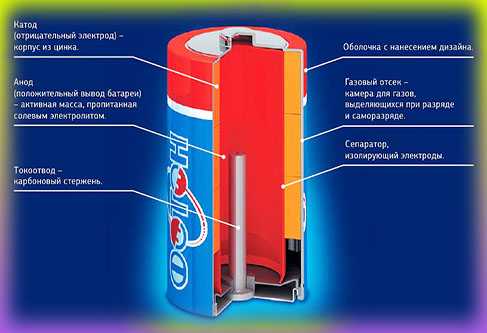
Литиевые батарейки — li ion
Самые современные. В отличие от щёлочных и солевых батареек, в состав катода входит литий (Li – наивысший отрицательный потенциал), в состав анода — различные материалы. Электролит — органический электролит. В связи с такими элементами литиевые батарейки получили большой срок хранения, большую плотность энергии и различную рабочую температуру.
что такое батарейка АА
Что такое батарейка типа АА — пальчиковые.
Что такое батарейка ААА — мизинчиковые (те, что мы привыкли использовать в пультах).
“Питер – АТ”
ИНН 780703320484
ОГРНИП 313784720500453
Как устроен элемент питания
Конструкция алкалиновых батареек предусматривает строение изделия как будто наизнанку, по сравнению с солевыми аккумуляторами:
- Внутри элемента содержится цинковая паста. В ней цинк находится в виде порошка, что увеличивает площадь его взаимодействия, от этого ёмкость аккумулятора выше, нежели у солевых аналогов.
- Цинк, загущенный специальным гелем, вырабатывает отрицательный потенциал, его снимает стержень из латуни.
- Диоксид марганца, смешанный с углеродной составляющей (графит, зола, сажа), отделяется от цинка с загустителем (анода) специальным сепаратором.
- Положительный вывод энергии выполнен в виде стального стакана с покрытием из никеля.
- Отрицательный вывод изготовлен из стальной тарелки.
- Оболочка изолирована от стакана. Это предупреждает возникновение замыкания. Ведь оба элемента расположены в одном отделении изделия.
- Также в щелочном элементе питания присутствует прокладка. Она берет на себя давление газов. Стоит отметить, что их выработка незначительна. Если сравнивать солевую и щелочную батарейку, то у второй газообразование снижено на 80%.
- Для защиты от взрыва данных элементов питания в конструкции предусмотрена камера для сбора газов и мембрана. Если давление внутри батареи очень велико, мембрана лопается, и происходит утечка электролитов.
Принцип работы батарейки
Как работает батарейка
Положительно заряженные частицы двигаются к отрицательным. Средой, где происходит данное движение, является электролит. Заряженные частицы образуются в процессе взаимодействия разных веществ. Весь принцип работы батарейки сводится к химической реакции.
Для прибора необходима нагрузка в виде лампочки или диода, в противном случае при контакте “плюса” и “минуса” может произойти короткое замыкание.
При работе элемента аноды окисляются и разрушаются. Со временем изделие теряет заряд и требует замены. Попытки восстановить его ни к чему хорошему не приведут, т.к. изменения, происходящие в батарее, необратимы.
Если попытаться зарядить конструкцию, то это приведет к взрыву или течи. Но ученым путем проб и ошибок удалось создать восполняемую батарею – аккумулятор.
Положительные и отрицательные свойства солевых батареек
Любая вещь в нашей жизни имеет свои положительные и отрицательные стороны. Уж так устроен этот мир. Ничем не отличается от остальных и солевая батарейка. Из её положительных качеств можно выделить то, что она небольшая по размеру и не много весит. Это очень удобно. А если давать иногда ей полежать без работы, то она сможет прослужить немного дольше.
Взбодрить «уставшую» батарейку можно энергично встряхнув или ударив об руку. От этого внутри неё выравниваются слипшиеся комки электролита и она ещё некоторое время успешно будет функционировать.
А вот отрицательных свойств у них больше:
- хранятся недолго (обычно срок их годности не превышает трёх лет);
- имеют склонность к самостоятельной потере заряда;
- электролит часто пересыхает;
- плохо переносят температурные перепады;
- от длительного хранения их корпус окисляется, и электролит вытекает — поэтому рекомендуется извлекать их из устройства, если им не пользуются;
- у них небольшая энергетическая ёмкость.