В чём отличие щелочных батареек от солевых и какие лучше
Итак, пора подвести итог в вопросе, чем отличаются солевые батарейки от щелочных (алкалиновых). Основное отличие, конечно, в электрической ёмкости. В зависимости от производителя и режима (тока) разрядки разница, как указывалось выше, может составлять от 1,5 до 5–7 раз!

Длительность работы солевых и щелочных батареек разных производителей при одинаковом разрядном токе
Как видно из диаграммы, щелочные элементы не только дольше работают, но и не так быстро теряют напряжение по мере разряда.
Следующее существенное отличие — внутреннее сопротивление. У щелочных оно намного ниже, чем у солевых, а это значит, что они могут отдавать большой ток, необходимый для питания мощных приборов, чего не скажешь о солевых, которые мощную нагрузку просто «не потянут», даже будучи новыми.
Ну и конечно, стоимость. Солевые батарейки стоят много меньше, и в некоторых случаях (см. раздел ниже) покупать их более выгодно, чем щелочные.
Какие лучше выбрать и в каком случае
Теперь осталось решить, какие из них лучше. Теоретически — щелочные, но тут не всё так просто и зависит от того, для питания чего будем батарейки использовать. Если, к примеру, нужно запитать электронно-механические или чисто электронные часы, то, без сомнения, лучше использовать солевые батарейки.

Такие часы не требуют много энергии
Стоят они немного, ток потребления устройством минимальный, так что одного элемента хватит на месяцы и даже годы. То же самое можно сказать и про питание других подобных устройств и гаджетов. К примеру, пультов ДУ для бытовой аппаратуры, миниатюрных детских игрушек без электропривода — всевозможных «гуделках», «пищалках» и пр.
Мнение эксперта
Алексей Бартош
Специалист по ремонту, обслуживанию электрооборудования и промышленной электроники.
Задать вопрос
Можно, конечно, всё вышеперечисленное запитать и щелочной батарейкой, но она намного дороже, а срок годности может выйти раньше, чем элемент успеет потратить весь свой заряд. Тут будет уместно выражение «из пушки по воробьям».
Где используются щелочные элементы? Их основная область применения — питание энергоёмких устройств, требующих больших токов. Если, например, поставить солевые батарейки в фотоаппарат «мыльница», то, скорее всего, они даже не смогут провернуть механизм протяжки плёнки, поскольку из-за высокого внутреннего сопротивления не способны развить большой ток. Тут решение одно — щелочная батарейка.

Этому фотоаппарату солевых элементов хватит на несколько снимков
То же самое касается и других «прожорливых» устройств — фото видеокамер, игрушек с электроприводом, фонариков, автономных активных колонок и т. п. Всё это требует качественных источников большой ёмкости, способных при необходимости отдать большой ток.

Фонарь — достаточно энергоёмкое устройство, и качественно запитать его можно только щелочными батарейками
Применение
Различные виды могут применяться по-разному, зависит это от их основных конструктивных свойств и характеристик:
- Элементы питания с твердым электролитом используют в устройствах с малым значением потребляемого тока. Например, часы фонарики с малой мощностью, а также пульты дистанционного управления.
- Щелочные батарейки применяют в электротехнике с повышенным значением тока, к ним можно отнести различные камеры и магнитофоны, а также игрушки с электродвигателем.
- Источники питания с серебряными электродами способны обеспечить электроэнергией в калькуляторах, переносных инструментах и аппаратах для улучшения слуха.
- Литиевые батарейки используют в портативной электронике, где необходимо стабильное значение емкости и потребляемого тока.
Принцип действия алкалиновой батарейки
 Принцип действия этого щелочного источника питания довольно прост. Его описал итальянский физик Алессандро Вольта в далёком 1782 году. Учёный сконструировал гальванический элемент, в котором цинковый анод и медный катод погружались в раствор серной кислоты. Разница потенциалов двух металлов, опущенных в электролит, создавала электрический ток.
Принцип действия этого щелочного источника питания довольно прост. Его описал итальянский физик Алессандро Вольта в далёком 1782 году. Учёный сконструировал гальванический элемент, в котором цинковый анод и медный катод погружались в раствор серной кислоты. Разница потенциалов двух металлов, опущенных в электролит, создавала электрический ток.
Своему названию этот вид батареек обязан веществу, выполняющему функцию проводника тока, а именно — концентрированному раствору щелочи. Производят электролит, используя в основном гидроксид калия или гидроксид натрия.
Другими обязательными участниками электрохимической реакции в алкалиновом элементе становятся — отрицательный электрод (из цинка) и положительный электрод (из оксида марганца). В зависимости от типа источника тока напряжение может составлять 1,5–12 В.
Отличие щелочных батареек от солевых
Чем отличаются солевые и щелочные элементы питания:
- конструкция аккумуляторов различаются типом анода (цинковый компонент используется в виде стакана или порошка, из-за чего во втором случае увеличивает площадь химической реакции);
- срок годности в 2-3 раза ниже, чем алкалиновых, при этом солевые элементы постепенно саморазряжаются даже без использования для питания техники;
- высокие токи разряда не подходят для солевых аккумуляторов из-за внутреннего сопротивления устройств, тогда как алкалайн-батарейки могут использоваться в качестве силового источника тока (в импульсных фотоосветителях, моделях на радиоуправлении);
- в работе при перепадах температур солевые батарейки нестабильны, на холоде теряют емкость заряда, в отличие от щелочных аналогов;
- удельная емкость алкалиновых элементов повышается при увеличении нагрузки и составляет показатель в 2-10 раз больше, чем у солевых;
- герметичность корпуса алкалиновых аккумуляторов позволяет не вынимать их из неработающего девайса, в случае солевого аналога риск вытекания раствора со временем возрастает;
- цена выше, чем солевых.
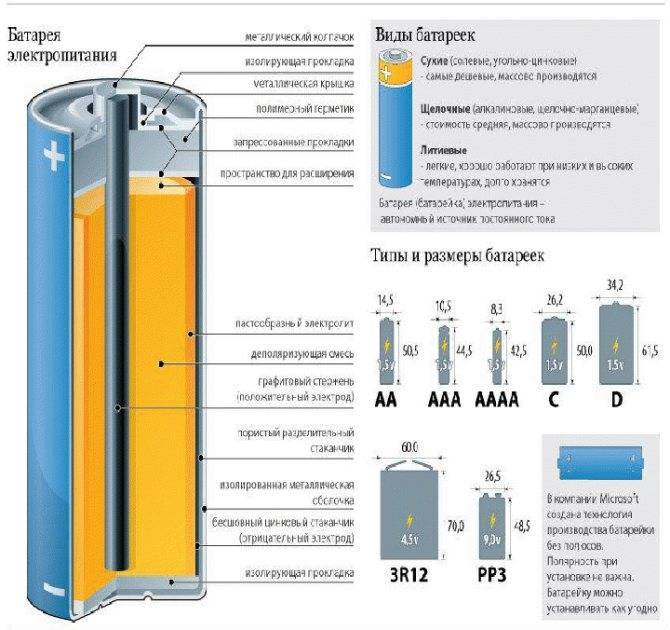
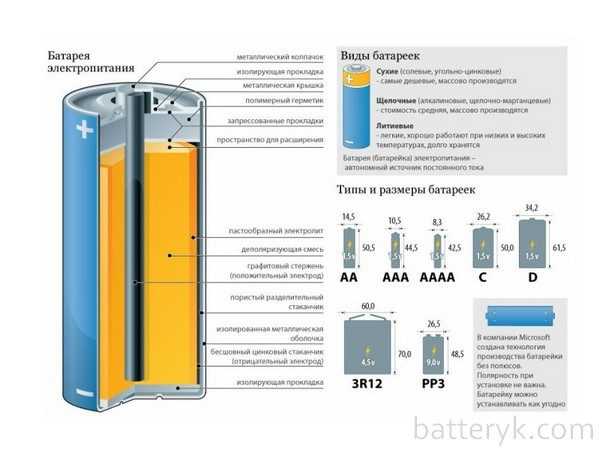
Виды батареек по химическому составу
В быту «батарейками» называют гальванические элементы, которые создают электрический ток за счет химической реакции. Гальванические элементы производят электрическую энергию благодаря реакциям между двумя металлами в растворе электролита. Один металл является «минусом», другой «плюсом». Между ними протекает реакция окисления (на «минусе») и восстановления (на «плюсе»), за счет которой и возникает ток.
Традиционно с химической точки зрения батарейки разделяют на виды в зависимости от того, какие металлы или какой тип электролита в них используется.
Солевые батарейки
Это старейший тип батареек, разработанный компанией Eveready еще в 20-х годах прошлого века. В качестве «минуса» в нем используется цинк, а в качестве «плюса» — двуокись марганца. Электролит, который обеспечивает протекание реакции — хлорид аммония. Это соль, поэтому батарейка называется солевой.
Солевые батарейки имеют международную маркировку R. Такие батарейки подходят для устройств, не требующих большой мощности питания: детских игрушек, пультов ДУ для телевизоров, часов, ручных фонариков, небольших радиоприемников.
Преимущества
дешевизна маленький вес возможность возобновить работу батарейки после разряда
Недостатки
невысокая выработка токане работают при минусовых температурахнебольшой срок храненияпроблемы с герметичностьюи быстрая разрядка при неиспользовании
Щелочные батарейки
Щелочные батарейки также называются алкалиновыми (от французского alcaline — щелочной). Они также состоят из марганца и цинка, но в качестве электролита, в котором протекает реакция, в них используется гидроксид калия. Это щелочь, поэтому у батарейки такое название.
Щелочная батарейка маркируется буквами LR. Эти батарейки подходят для устройств со средним и высоким потреблением тока, таких как ручные прожекторы, плееры и диктофоны, фотоаппараты.
Преимущества
большая емкость, чем у солевых могут работать при низких температурах герметичны малая скорость саморазряда — могут храниться до 7 лет
Недостатки
цена чуть вышеболее тяжелый весодноразовые — после выработки заряда использоваться больше не могут
Ртутные батарейки
В этих батарейках в качестве «минуса» служит цинк, а «плюса» — оксид ртути. Они разделяются слоем электролита, в роли которого выступает 45% раствор щелочи (гидроксид калия, как и в алкалиновых).
Ртутные батарейки в наше время используются очень редко из-за общеизвестного факта: ртуть токсична. Однако еще в недалеком прошлом они активно применялись в электронных часах, весах, медицинской технике — слуховых аппаратах, кардиостимуляторах.
Преимущества
стабильность напряжения большая ёмкость высокая энергоплотность стойкость к перепаду температур долгое время хранения
Недостатки
ядовитость ртути при нарушении герметичностидороговизнасложность утилизации
Серебряные батарейки
Есть и такие. В них роль «минуса» опять играет цинк, а роль «плюса» — оксид серебра. Реакция с выделением электрического тока протекает при помощи щелочного электролита — гидроксида калия или натрия.
Международная маркировка серебряной батарейки — SR. Используются они в тех же сферах, что и ртутные, и по достоинствам и недостаткам практически им аналогичны. Главное преимущество серебряных батареек перед ртутными — безопасность: серебро нетоксично, и при нарушении герметичности корпуса нет риска отравления. Главный минус — серебряные батарейки дороже всех остальных видов батареек.
Литиевые батарейки
Наконец, последний тип батареек — литиевый. У этих батареек в качестве «плюса» используется литий, а вот «минус» и электролит могут быть представлены различными веществами: диоксид марганца, монофторид углерода, пирит, тионилхлорид и другие.
Литиевые батарейки могут использоваться в разной портативной электронике и имеют маркировку CR. Они объединяют в себе все преимущества предыдущих типов и, по факту, являются самым хорошим гальваническим элементом питания. Но по сравнению с щелочными и солевыми элементами литиевые батарейки дороговаты (хотя в зависимости от используемых веществ цена может сильно различаться). Поэтому первые тоже выпускаются в большем количестве для бюджетного сегмента.
Преимущества
легкость долгое время хранения (до 12 лет) термическая стойкость стабильное напряжение высокая энергоплотность и энергоемкость
Недостатки
высокая стоимость
Как видите, литиевые батарейки — это единственный тип, у которого достоинства решительно перевешивают недостатки. Поэтому рекомендуем попробовать:
Устройство батарейки: из чего состоит, принцип работы
Устройство батарейки несложное, но без нее трудно представить современную жизнь. Она применяется повсеместно во многих бытовых приборах. С данными источниками питания знакомы даже маленькие дети, ведь все электронные игрушки работают от них. А вот как работает батарейка и из чего она сделана, знают далеко не все.
Что ж, давайте рассмотрим принцип работы обычной батарейки.
Краткое описание
Прежде чем разбираться, из чего состоит батарейка, выясним, что это такое. Батарейка – это наипростейшее устройство для получения электричества, которое представляет собой гальванический элемент. Суть работы элемента составляет метод, основанный на химическом взаимодействии одних веществ с другими.

Изобретателем считается ученый Алессандро Вольта. Но есть данные, которые свидетельствуют о том, что гальванические устройства появились задолго до того, как их разработал физик.
Теперь можно приступить к знакомству с тем, как устроена привычная всем нам батарейка.
Принцип работы
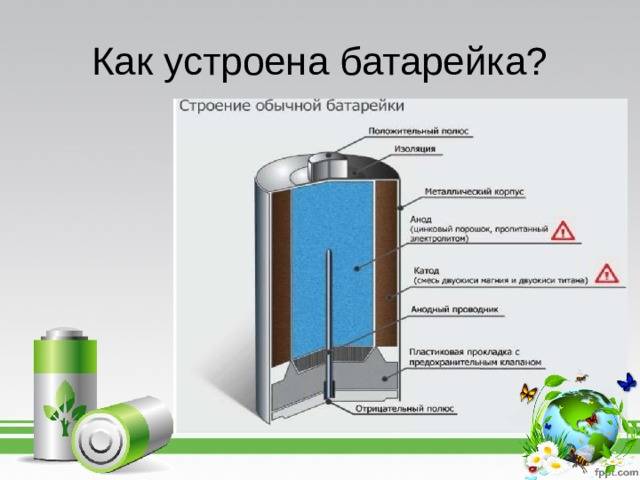
На прилавках магазинов представлено множество различных видов батареек. У них есть небольшие различия, но вот работают они все по одной схеме. Если есть старая батарейка, сделайте ее разбор, и вы увидите, какова ее анатомия.
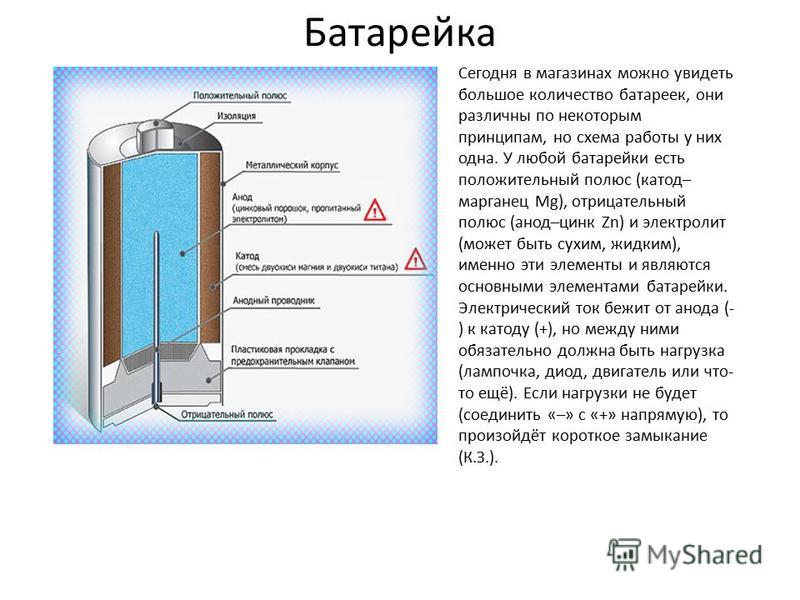
Каждая из них имеет в своем строении несколько элементов, состоящих из:
- положительного полюса – анода (цинк);
- отрицательного полюса – катода (марганец);
- электролита – сухого или жидкого.
Вот эти три компонента батарейки и определяют ее состав.
Принцип работы устройства такой: происходит поступление электрического тока с положительного заряда (анода) на отрицательный (катод)
При этом важно помнить, что необходимо присутствие нагрузки: лампочки, двигателя, диода или какого-либо иного элемента. Отсутствие нагрузки во время соединения «плюса» с «минусом» грозит коротким замыканием
Катоды выступают восстановителем. Они получают электроны от поступившего анода. Электролит представляет собой среду для передвижения ионов, образовавшихся в результате химических реакций.
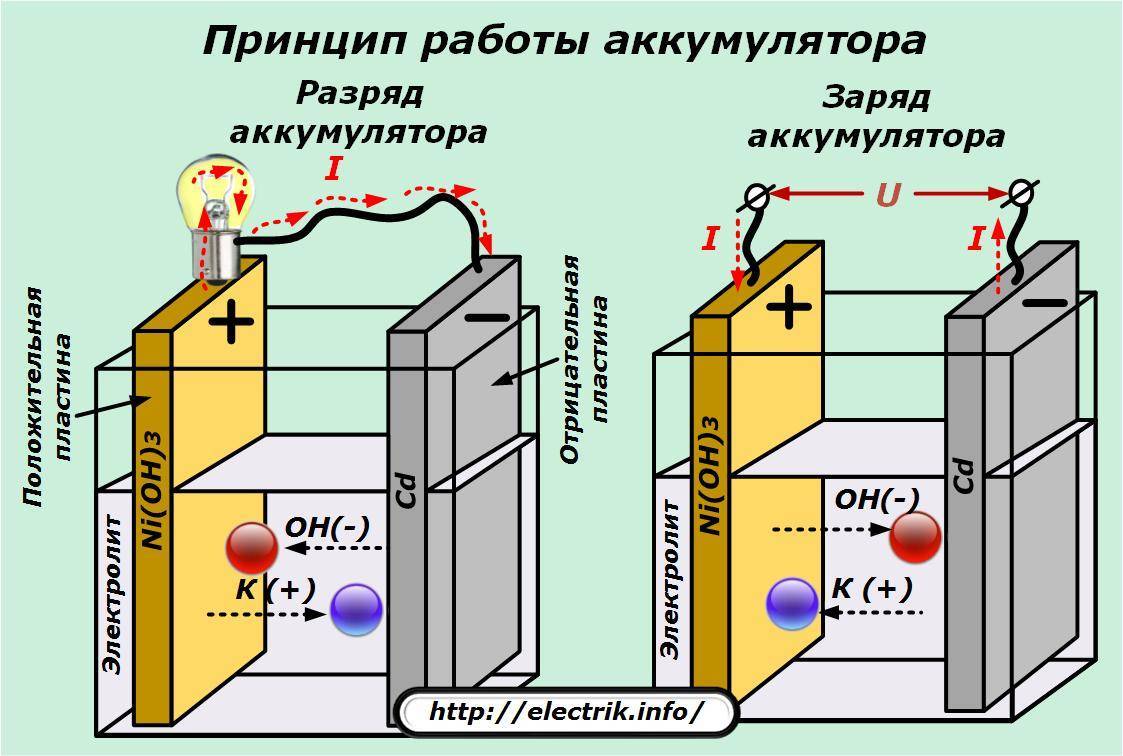
В процессе эксплуатации аккумуляторов постоянно образуются определенные вещества, аноды же в ходе работы элемента приходят в негодность, разрушаются, окисляются. Таким образом источник питания садится.
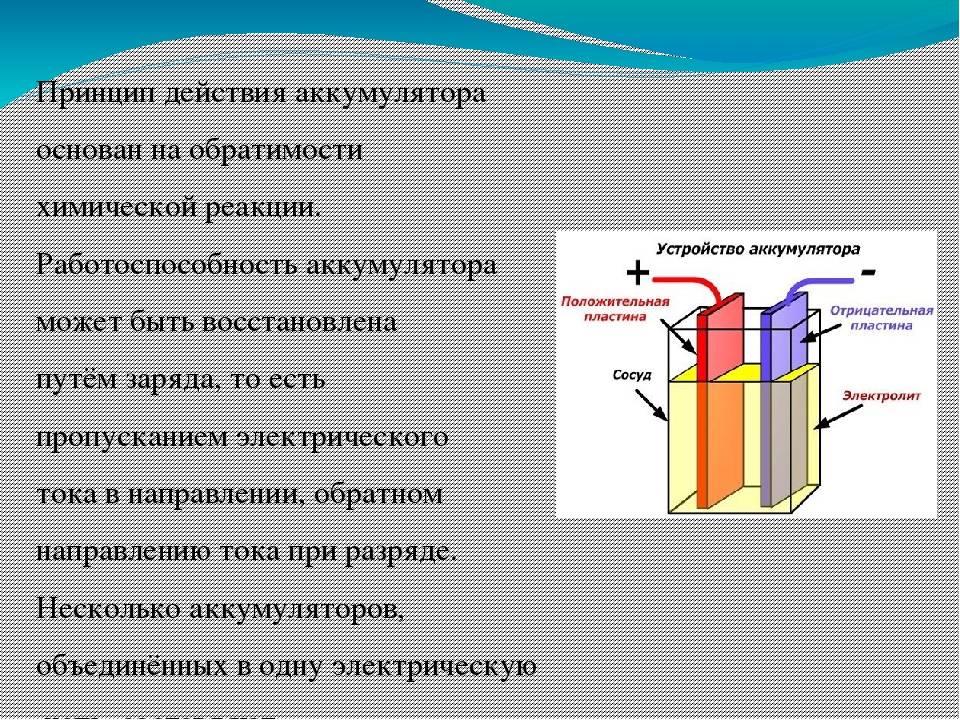
Многих интересует вопрос: «А возможно ли его заряжать?» Все, что происходит в батарейках – необратимо. Поэтому гальванические элементы не заряжаются. Но с помощью достижений науки есть возможность возвратить изначальное состояние элементам. Для этого необходимо пропустить электрический ток в противоположную сторону, то есть от катода к аноду. Такие источники питания получили название аккумулятора, а сам процесс мы видим на примере обычной зарядки.

Но вот традиционные устройства с помощью этой рецептуры зарядить нельзя. Они не подходят для повторного использования, так как это чревато взрывом или течью химических элементов из корпуса.
Какими бывают батарейки
Существует несколько типов элементов. В большинстве своем они солевые или щелочные. Жидкими не пользуются, потому что при переворачивании они выходят из строя. Слишком текучий электролит загущают.
Батарейки, в зависимости от состава, могут быть таких видов:
Помимо специфического состава, эти источники тока отличаются своими параметрами и объемом заряда.
Теперь вы знаете, каким характеристикам соответствует работа гальванического элемента. Если хотите все увидеть наглядно, разберите старую батарейку из сухих элементов и изучите ее устройство.
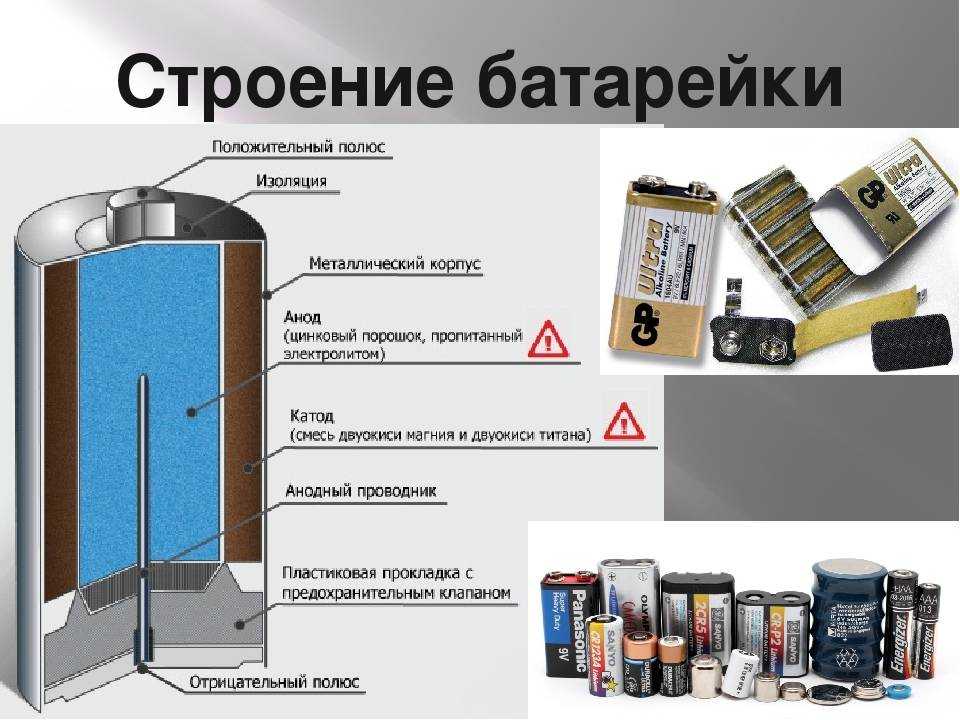
Устройство батарейки
Конструкционные особенности батареек связаны, прежде всего, с их размерами и формой.
Цилиндрической
Цилиндрическая батарейка имеет вытянутый корпус. Оболочка в таких элементах чаще состоит из металла. Эта часть надёжно изолирована от внутренних деталей.
Сразу после диэлектрической оболочки следует тонкий стакан из токопроводящего металла (цинка в солевых батареях). Этот элемент соединяется с отрицательным выводом батарейки.
В середине цилиндрического элемента питания располагается графитовый стрежень, который является положительным выводом. В контактной части на эту деталь надевается металлический колпачок для защиты от механических повреждений.
В пространстве между центральным стержнем и отрицательной оболочкой находится электролит и деполяризующая смесь.

Круглой (миниатюрной)
Кнопочная батарея является незаменимым элементом питания в наручных часах и других миниатюрных электрических устройствах. Срок службы таких батареек, как правило, выше чем у пальчиковых, но причина длительной работы связана, прежде всего, с небольшим электропотреблением устройств, в которые устанавливается данный элемент.
Состоит такая батарейка из положительного и отрицательного полюсов, между которыми находятся вещества, вступающие в химическую реакцию при подключении к источнику тока потребителей.
Разноимённые контакты в таких изделиях надёжно изолированы друг от друга диэлектрическим материалом. Наиболее часто кнопочные батареи производят по воздушно-цинковой технологии.
Крона
Крона отличается от других батареек тем, что внутри элемента находится 6 небольших источников питания по 1,5 Вольт. Принцип работы каждого отдельного изделия не отличается от пальчиковых или кнопочных батарей.
Корпус батарейки «Крона» изготавливается из металла, но также может использоваться прочный пластик. Отдельные элементы располагаются сверху вниз и подключаются последовательно. Положительный и отрицательный выводы находятся на одной из плоскостей, которая изготавливается из диэлектрика.
Батарейка и всё о ней
Батарейка — это слово плотно вошло в нашу повседневную жизнь. Но, к сожалению, сегодня мало кого интересует её история, устройство, её виды. Давайте вместе разберёмся с этими и другими интересными вопросами о батарейке. А точнее «что такое батарейка», «как работает батарейка». Повседневная жизнь не требует каких-то великих усилий для включения телевизора, калькулятора, для нормальной работы настенных часов, для работы компьютерной мыши и так далее. А все благодаря каким-то батарейкам, которые помогают упростить нашу жизнь, помогают сэкономить наше время. Это понимает каждый здравомыслящий человек, но не каждый задаёт себе вопрос: «как из таких маленьких батареек совершается такой объём работы», «как устроены батарейки»… А, между тем, это физика.
Самые первые прототипы батареек появились ещё в Месопотамии около 2000 лет назад. Состояла она в то время из глиняной вазы, медного и железного стержней, залитыми битумом. Кстати, если такой сосуд залить кислотой (уксусной, серной), то получим напряжение примерно в 1В. Назвали такой прототип «Багдадской батарейкой » в связи с местом, на котором были обнаружены. Примерно в 1800 году итальянский физик Алессандро Вольта изобрёл батарейку, которой мы и по сей день продолжаем пользоваться. Кстати, кто не знает что такое батарейка, так это источник питания, который вырабатывает электричество под действием химического процесса. То есть батарейка это гальванический элемент, работающий на химической реакции. Так можно объяснить и детям.
____________________________________________
Возможно, вам будет интересно: Почему батарейки кислые на вкус?
__________________________________________________________________
Как работает батарейка
Сегодня в магазинах можно увидеть большое количество батареек, они различны по некоторым принципам, но схема работы у них одна. У любой батарейки есть положительный полюс (анод–цинк Zn), отрицательный полюс (катод–марганец Mg) и электролит (может быть сухим, жидким), именно эти элементы и являются основными элементами батарейки. Электрический ток бежит от анода (+) к катоду (—), но между ними обязательно должна быть нагрузка (лампочка, диод, двигатель или что-то ещё). Если нагрузки не будет (соединить «–» с «+» напрямую), то произойдёт короткое замыкание (К.З.). Катоды выполняют функцию восстановителя, т.е. принимают электроны от прибывшего анода. Электролит это среда, в которой перемещаются ионы, которые образуются в процессе химической реакции. В процессе работы батарейки постепенно образовываются новые вещества, а электроды постепенно разрушаются — батарейка садится. Вот и вся работа батарейки, кстати, все процессы, проходящие в гальваническом элементе, необратимы, то есть заряжать батарейки нельзя. Кратко говоря о работе батарейки: анод — нагрузка — катод — электролит. Электролит изначально изготовляли в жидком виде, но это неудобно, так как при переворачивании батарейки она просто не работала. Из-за этого электролит стали загущать, превращать его в сухой вид.
Виды батареек
Солевые (угольно-цинковые, марганцево-цинковые) батарейки.
Изготовляются из пассивного угля и двуокиси марганца, электролит из хлорида аммония и катод из цинка. В перерывах работы элементы питания могут восстанавливаться, т.е. выравнивать локальные неоднородности в композите электролита, вызванных разрядом. Такой процесс немного продлевает срок службы батарейки.
Алкалиновые (щёлочные) батарейки
В отличие от солевых батареек у этих химический элемент электролита — щелочной электролит. Щёлочные батарейки (алкалин) имеют продолжительный срок хранения, а в процессе эксплуатации напряжение на электродах меняется гораздо меньше, чем у элементов с солевым раствором.
Литиевые батарейки — li ion
Самые современные. В отличие от щёлочных и солевых батареек, в состав катода входит литий (Li – наивысший отрицательный потенциал), в состав анода — различные материалы. Электролит — органический электролит. В связи с такими элементами литиевые батарейки получили большой срок хранения, большую плотность энергии и различную рабочую температуру.
что такое батарейка АА
Что такое батарейка типа АА — пальчиковые.
Что такое батарейка ААА — мизинчиковые (те, что мы привыкли использовать в пультах).
“Питер – АТ”
ИНН 780703320484
ОГРНИП 313784720500453
Особенности, плюсы и минусы алкалиновых батареек
Главная отличительная черта щелочных элементов питания кроется в составе электролита. Если говорить простыми словами, он состоит из щёлочи. Именно поэтому они так называются.
В качестве примера можно рассмотреть состав наиболее популярных источников тока, активное вещество которых состоит из хлорида цинка. В отличие от солевых вариантов, алкалиновые АКБ содержат жидкость, содержащую раствор щёлочи. Чаще всего для этого используют оксид калия.
Щёлочь взаимодействует с контактами батарейки, в результате чего выделяется электрический ток. Причём выделяется гораздо большее количество электроэнергии, чем при использовании солевого раствора. Поэтому щелочная батарейка отличается высокой производительностью и общим КПД.
Классификация изделий по их размеру помогает подобрать нужный вариант. Обычно для этого используется буквенное обозначение, которое применяют ко всем элементам питания. Чаще в ассортименте магазинов можно встретить следующие модели:
- «Таблетки». Имеют плоскую форму, которая объясняет их название. Они представляют собой небольшой диск, заключённый в металлический корпус. Это позволяет использовать «таблетки» даже при неблагоприятных погодных условиях. Благодаря небольшому размеру они нашли широкое применение в компактных устройствах — часах, брелоках сигнализации, слуховых аппаратах.
- «Мизинчиковые». Соответствующая маркировка — AAA Alkiline — поможет вам отличить их от солевых «собратьев». Это довольно мощные устройства, поэтому их можно использовать в фонариках, детских игрушках, пультах дистанционного управления.
- «Пальчиковые». Самый распространённый вариант элементов питания, маркируется буквами АА. Чаще используются в приборах, которым требуется значительное напряжение при компактных размерах батареек.
- «Крона». Представляет собой бочонок прямоугольной формы. Главное преимущество модели — способность выдавать повышенное напряжение, без подключения к сети.
Главные достоинства щелочных элементов питания:
- Герметичный корпус и небольшое выделение газов в ходе химической реакции. Благодаря этому снижается риск вытекания электролита.
- Могут храниться в течение пяти лет. При этом они не теряют первоначальный заряд.
- Несмотря на компактные размеры, обладают высокой ёмкостью. Поэтому они служат дольше, чем солевые аналоги.
- Хорошо переносят климатические изменения. Диапазон рабочих температур варьируется от –40 до +50.
- Разряжаются равномерно, нет резкого падения напряжения.
К отрицательным чертам можно отнести:
- Стоимость выше, чем у солевых батареек.
- Требуют правильной утилизации. В состав электролита входят различные химические соединения — при попадании на почву, они могут нанести непоправимый вред окружающей среде. Поэтому их необходимо сдавать в специальные пункты приёма.
- Продукция некоторых производителей имеет большую массу.
- Нельзя повторно заряжать. При попытке зарядить устройство вы рискуете своим здоровьем — во время зарядки изделие нагревается, отчего корпус взрывается. Из-за этого едкие химические вещества могут попасть на одежду, кожу или слизистые.
Алкалиновые батарейки способны прослужить вам в течение длительного времени. Главное — приобретать изделия проверенных марок, а элементы питания, которые вышли из строя, сдавать в специальные пункты приёма.
Батарейки
Батарейка – это бытовое название одноразового неперезаряжаемого гальванического
элемента. Гальванический элемент – это химический источник тока, т.е. напряжение,
возникающие на его выводах является результатом химической реакции.
Батарейки бывают различных форм и типоразмеров. Но практически
все популярные батарейки делятся на три основных типа:
- Солевые – батарейки угольно-цинковые с солевым электролитом. Напряжение 1,5В.
- Щелочные или алкалиновые (от английского alkaline – щелочной) – батарейки марганцево-цинковые с щелочным электролитом. Напряжение 1,5В.
- Литиевые – обычно имеют форму диска. Напряжение 3В.
Батарейки другого напряжения состоят из нескольких последовательно соединенных
гальванических элементов, размещенных в одном корпусе. Так батарейка 4,5В
состоит из трех гальванических элементов по 1,5В.
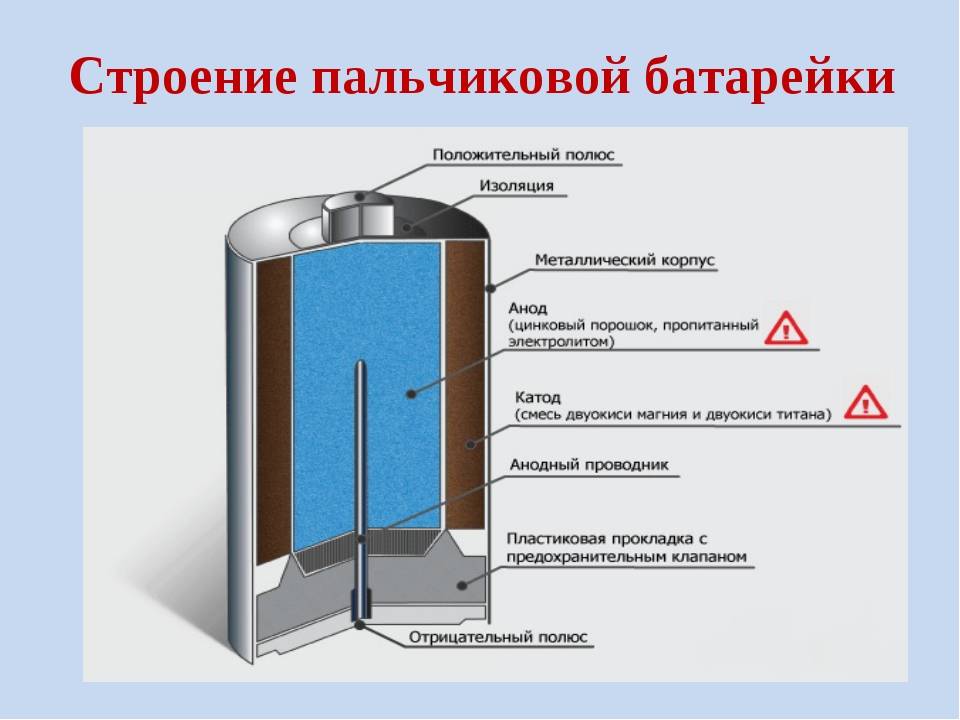
Как устроена батарейка
Принципиально каждая батарейка имеет в своем строении несколько элементов,
состоящих из: положительного полюса – анода, отрицательного полюса – катода
и электролита – сухого или жидкого. Эти три компонента батарейки и определяют
её состав.
Несмотря на принципиальное сходство, батарейки разного типа устроены по-разному.
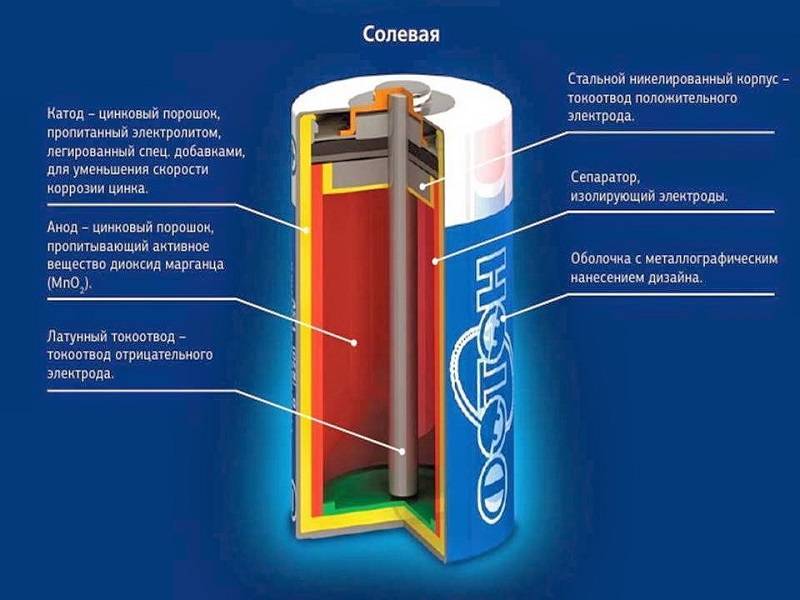
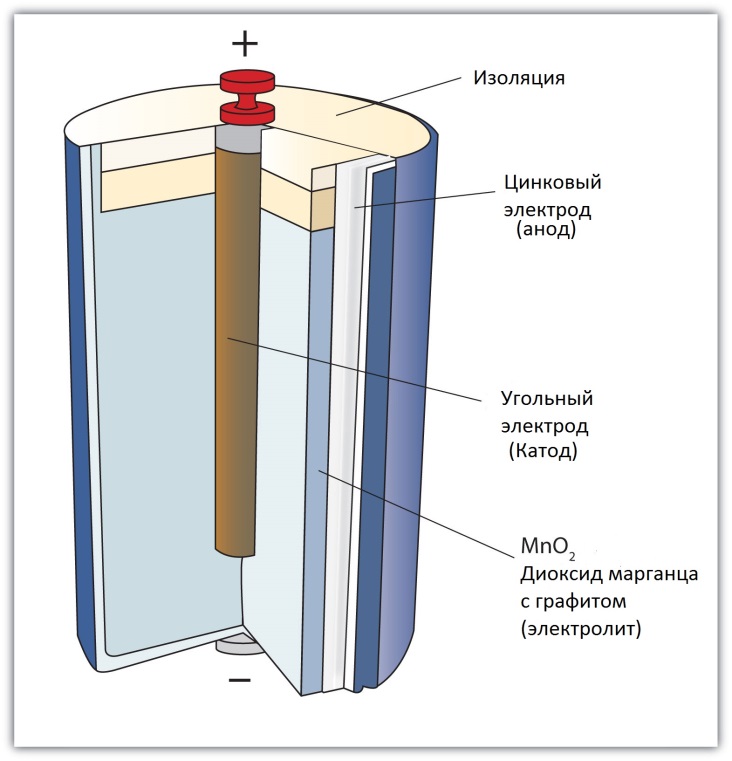
Солевая батарейка состоит из следующих элементов:
- (1) – металлической колпачок,
- (2) – графитовый электрод (“+”),
- (3) – цинковый стакан (“-“),
- (4) – оксид марганца,
- (5) – электролит,
- (6) – металлический контакт.
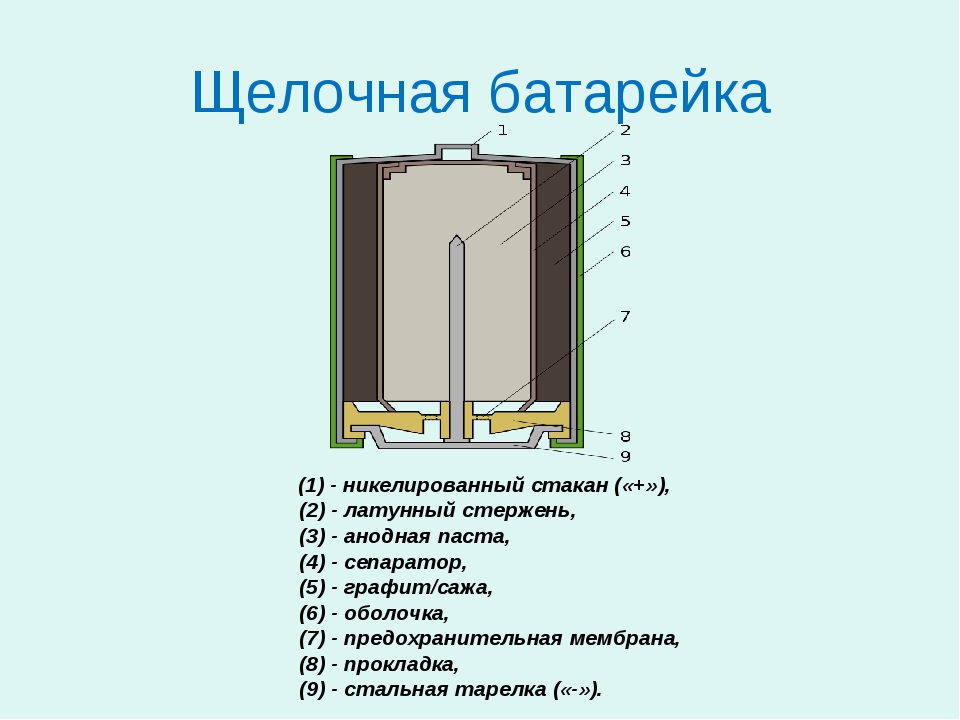
Устройство щелочной батарейки приведено на картинке ниже:
- (1) – никелированый стакан (“+”),
- (2) – латунный стержень,
- (3) – анодная паста,
- (4) – сепаратор,
- (5) – графит/сажа,
- (6) – оболочка,
- (7) – предохранительная мембрана,
- (8) – прокладка,
- (9) – стальная тарелка (“-“).
Разбирать батарейки категорически не рекомендуется, особенно с детьми, это опасно для здоровья!
Как устроена батарейка
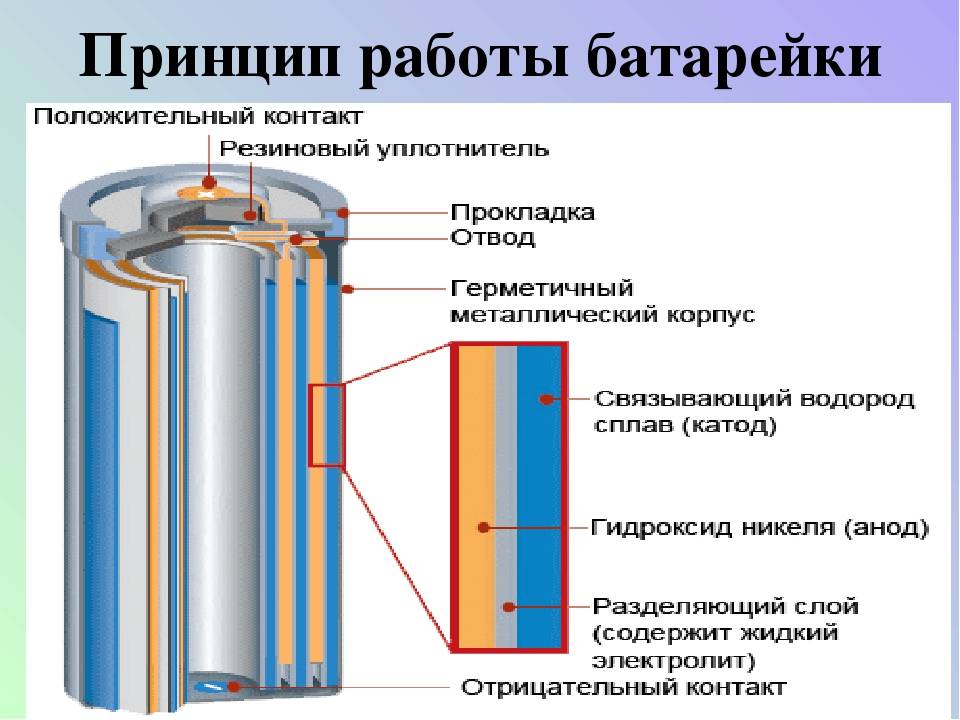
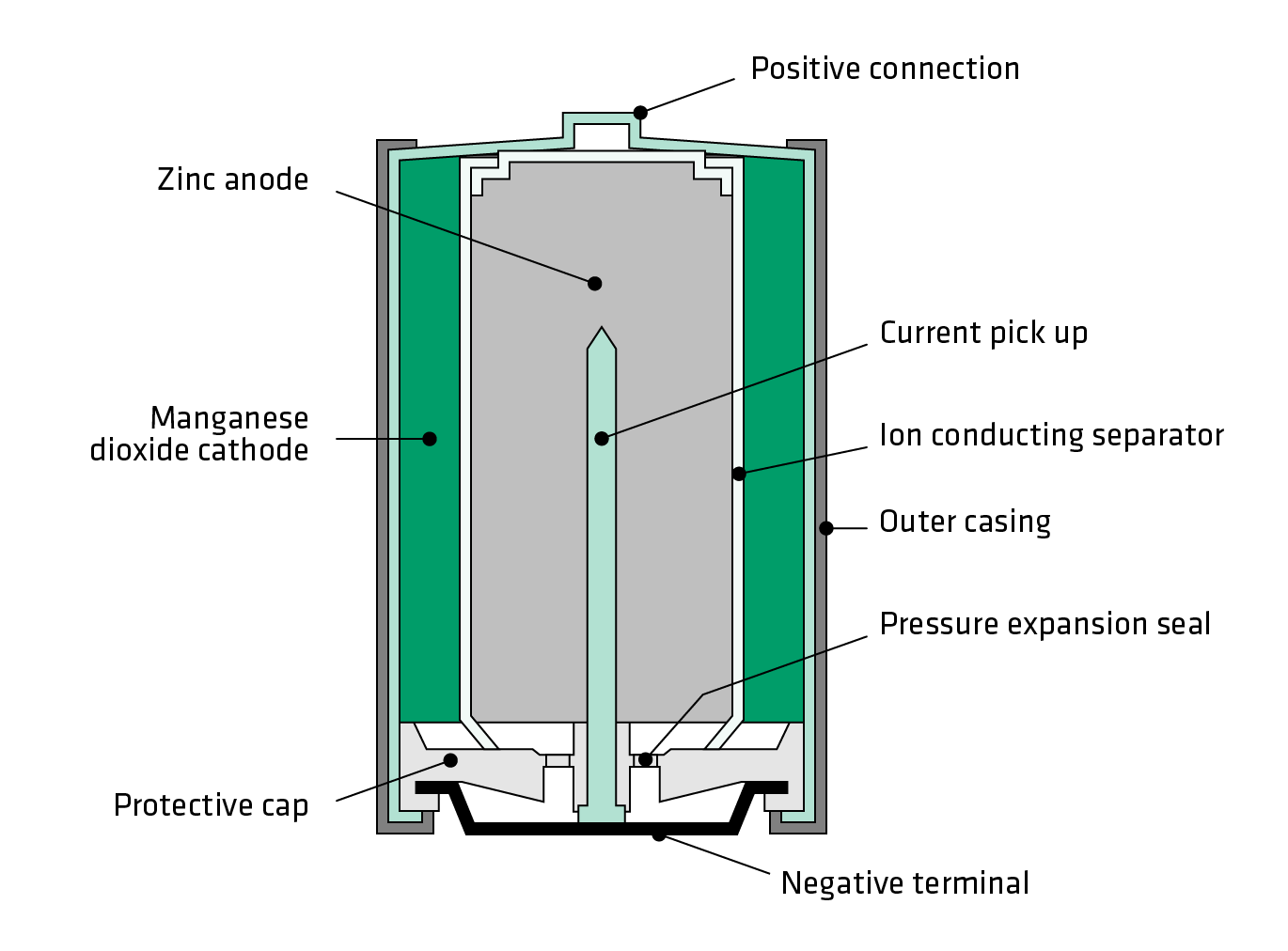
Внутри металлического корпуса щелочной ячейки находятся три основных химических вещества: цинк, диоксид марганца и гидроксид калия.

Щелочная батарейка. /Роджер Кларк
Это может показаться сложным, но способ производства электричества в батарейке на самом деле довольно прост: происходит химическая реакция, которая перемещает крошечные отрицательно заряженные частицы, называемые «электронами», вокруг, чтобы создать электрический ток.
Когда элемент подключен к цепи — например, к лампочке, — цинк внутри реагирует с диоксидом марганца и теряет электроны.
Электроны собираются с помощью металлического стержня внутри ячейки, что позволяет им течь из нижней части ячейки (отрицательный), через провода к лампе (чтобы она загорелась), а затем обратно в верхнюю часть ячейки. (положительный).
Эта реакция производит около 1,5 вольт электроэнергии. Поскольку не так много устройств могут работать при напряжении 1,5 В, очень часто два или четыре элемента используются вместе для увеличения мощности. Таким образом, четыре ячейки, соединенные вместе (конец в конец), дадут шесть вольт.

Когда большая часть цинка прореагировала с диоксидом марганца, мы говорим, что элемент «плоский», что означает, что он больше не может производить электричество. Поскольку химическая реакция, происходящая в щелочных элементах, не может быть легко изменена, это означает, что элемент не может быть перезаряжен.
Но помните, что большинство элементов и батарей можно утилизировать, поэтому убедитесь, что вы тщательно от них избавились.
Корпус для батареек и из чего он сделан?
Такая деталь батарейки как корпус играет очень значительную роль. По сути она удерживает все ее содержимое и предотвращает от распада деталей в разные стороны.
В каких батарейках цинковый корпус?
Многих интересует данный вопрос и это не спроста. Цинк можно использовать для различных экспериментов. Или же его можно просто продать. Цинковым корпусом обладают солевые источники питания. Обычно на них стоит надпись что они солевые.
Последнее время встречаются элементы питания, поверхность которых сделана из железа, жести. Это связано с тем что находится внутри источников энергии. Для повышенной прочности и защиты требуется именно такой кожух.
Из чего состоит корпус пальчиковой батарейки?
Он имеет простое устройство и состоит из нескольких частей:
- Верхняя
- Нижняя
- Боковая овальная
- Маркировка
Но под корпусом порой люди имеют ввиду отсек куда вставляются элементы питания. Например, по типу такого:
Корпус для батареек xbox 360
Он выглядит по типу так:
Можно изготовить корпус для батареек своими руками. Но на это нужно время. Ниже в видео представлено как это можно сделать из подручных средств.
Примерный химический состав всех батареек
В каждом типе энергетических накопителей содержатся разные химические элементы. Вот химические элементы, встречающиеся в источниках энергии:
- Никель
- Кадмий
- Свинец
- Ртуть – сейчас уже редко используется.
- Литий
- Цинк
- Марганец
- Алюминий
- Железо
Таким образом по составу элементы питания выглядит как-то так! Но устройство энергетического элемента не может включать в себя сразу все эти вещества.
В итоге из чего сделаны батарейки теперь понятно.