Способ третий: медные монеты
Ингредиентами для изготовления такой батарейки своими руками являются:
- медные монеты;
- алюминиевая фольга;
- плотный картон;
- столовый уксус;
- провода.
Нетрудно догадаться, что электроды будут медные и алюминиевые, а в качестве электролита используется водный раствор уксусной кислоты.
Монеты для начала нужно очистить от окислов. Для этого их потребуется ненадолго опустить в уксус. Затем изготавливаем кружочки из картона и фольги по размеру монет, используя одну из них в качестве шаблона. Вырезаем кружки ножницами, картонные кладем на некоторое время в уксус: они должны пропитаться электролитом.
Затем из ингредиентов выкладываем столбик: сначала монету, затем – картонный кружок, кружок из фольги, снова монету и так далее, пока материал не иссякнет. Конечным элементом снова должна стать медная монета. К крайним монеткам можно заранее припаять провода. Если паять не хочется, то проводки прикладываются к ним, и вся конструкция плотно оборачивается скотчем.
В процессе работы этой батарейки, собранной своими руками, монеты придут в полную негодность, так что не стоит использовать нумизматический материал, представляющий культурную и материальную ценность.
Что и как удобрять
Основную потребность в цинке и марганце испытывает кукуруза. Эта сельскохозяйственная культура особенно отзывчива на подкормки в следующие периоды произрастания:
начало появления листьев, уже 3 – 4 зеленых лепестка – сигнал огороднику;
возникновение метелок.
На протяжении вегетации кукуруза, как установлено, поглощает до 80 грамм марганца и в пять раз больше цинка на гектар посевов. Поэтому, если почва испытывает дефицит микроэлементов, батарейки придутся весьма кстати. Особенно актуальна подобная проблема для нейтральной или щелочной почвы.
Недостаток марганца в скрытой форме у кукурузы, характерен для культур, произрастающих на почвах с нейтральной, щелочной реакцией. Добавление азотных удобрений, содержащих Mn, способствует повышению урожайности на 10%.
Ликвидировать потребность в цинке можно опрыскивая побеги кукурузы 25-процентным раствором сернокислого цинка. Убедиться в необходимости процедуры можно заметив светлые полосы на листьях растений. Это реакция на недостаток цинка.
Альтернативно, отработанные батарейки могут заменить препарат Opticoat, используемый для инкрустации семян кукурузы марганцем и цинком. В частности, финны, которые вместе с североамериканцами, интенсивно используют утилизацию аккумуляторов под удобрения, комбинируют фосфор с полученными микроэлементами: Mn, Zn. Это способствует полевой всхожести посевов.
Мифы и реальность
Современная наука смогла доказать наличие собственного электромагнитного поля вокруг планеты. Оно не только создает естественные колебания в атмосфере Земли, но и призвано защищать все человечество от воздействия солнечного излучения, пыли и других мелких частиц, которые могли бы попасть из космоса. С теоретической точки зрения, если разместить один электрод на поверхности грунта, а второй поднять вверх на 500 м, то между ними получится разность потенциалов около 80 В. Если пропорционально увеличить расстояние до 1000 м, то и уровень напряжения должен увеличиться в два раза.
Однако на практике все получается далеко не так складно:
- Во-первых, электроды должны иметь достаточно большую площадь, из-за чего они будут обладать парусностью и возникнут сложности с их массой и фиксацией на высоте.
- Во-вторых, электромагнитное состояние поля земли непостоянно, поэтому оно во многом зависит от различных факторов и его распределение в пространстве также неравномерно.
- В-третьих, верхний электрод будет главным претендентом на притяжение разрядов атмосферного электричества, что приведет к перенапряжению в генераторе.
Тем не менее, определенные опыты получения бесплатного электричества все же существуют, но их практическая реализация носит скорее экспериментальный, чем предметный характер.
Как приручить животных
Когда вы разберетесь в основных механиках крафта, вам нужно перейти с Первобытного в Индустриальный век. Сперва соорудите верстак, затем с его помощью постройте большой каменный монумент. Чтобы перейти из одного века в другой, соберите необходимое количество материалов и нажмите на соответствующую клавишу.
Теперь вам доступна печь. Нужно скрафтить простую кирку и с ее помощью собрать немного медной руды (большой камень коричневого цвета). Собрав руду, вам нужно поставить печь и переплавить ее в слитки. Теперь на верстаке сделайте медную кирку. Медные слитки также пригодятся, чтобы скрафтить наковальню и мастерскую для экипировки.
Это самое основное, что вам нужно сделать на первых порах. После этого вы быстро сообразите, что нужно делать дальше. Чтобы приручать и ловить зверей, вам нужно создать призму монстров. Для этого понадобится:
- Железный слиток (3);
- Песок (2).
Теперь, когда призма у вас в инвентаре, найдите любое животное и нанесите ему критический урон (он не должен погибнуть!). Когда здоровье животного будет на минимуме, используйте на нем призму. Следует помнить, чем больше животное по размерам, тем больше призм понадобится для его захвата. Конечно, «приручением» это назвать сложно. Больше всего вышеописанные действия походят на захват зверя в специальную оболочку.
Как сделать батарею из монет?
По сути это простейшая батарейка. Ее называют некоторые мудрецы вольтовым столбом. Так как она похожа на первую батарейку, созданную профессором Вольтом.
Вот что потребуется для изготовления:
- Медные монетки. Можно брать по 50 или 10 копеек.
- Бумагу.
- Фольгу.
- Сильно соленая вода или уксус.

Чтобы самоделка имела красивый эстетический вид лучше брать одинаковые монеты. Перед началом опытов их нужно обмакнуть в уксус. Это поможет убрать грязь и оксидный налет. Дальше нужно изготовить из фольги и бумаги кругляшки формой как монетки. Их должно быть на 2 штуки меньше чем монеток, так как нужны контакты для крепления проводников.
Данный монетный столб изготавливается по следующему алгоритму:
- Вымоченная бумажка в уксусе или сильном солевом растворе прилепляется к монетке.
- Поверх бумаги ложится кружок из фольги.
- После этого устанавливается монетка.
- Все повторяется до тех пор, пока медные монетки не закончатся.
- У вас с одного конца должен получится плюс, а с другого минус.
Помните о том, что большое количество монеток даст вам больше напряжения. Когда данный опыт закончится монеты заржавеют и будут не годными для дальнейшего использования в быту.
Когда между фольгой и монетой находится электролит образуется разность потенциалов и в итоге образуется ток.
Меры безопасности
В зарядное устройство можно устанавливать только перезаряжаемые аккумуляторы. Установка в ЗУ гальванических элементов запрещена, т.к. приводит к протеканию электролита из батарейки и поломке зарядного устройства. В случае попадания электролита на кожу нужно незамедлительно промыть этот участок тела проточной водой. Химические элементы тока необходимо хранить вне доступа детей, а вышедшие из строя элементы – сдавать на утилизацию в специализированные компании, чтобы избежать загрязнения окружающей среды.
Наша предыдущая статья посвящена балансирам для LiFePO4 аккумуляторов.
Кислота и свинец
Наиболее проста в устройстве свинцово-кислотная конструкция для накопления электроэнергии. Для её сборки требуются:
- устойчивая ёмкость, с возможностью её плотного закрытия крышкой;
- электролит – раствор аккумуляторной кислоты и дистиллированной воды;
- свинцовая пластина – можно использовать сплющенный кусок свинца с кабельной изоляции или приобретённый в охотничьем или рыболовном магазине;
- два металлических штыря – электроды, которые необходимо вбить вертикально в свинцовые пластины.
Далее приведем сам процесс изготовления этого устройства. Пластины свинца одеваются на металлические штыри, с небольшим расстоянием между ними. После чего конструкцию погружают в ёмкость с залитым электролитом. Свинец должен полностью находиться под раствором. Контактные концы штырей проводят через крышку ёмкости и надёжно фиксируют на ней. К концам электродов можно подключить потребитель электроэнергии. Ёмкость устанавливают на устойчивой поверхности, после чего заряжают устройство. Усложнив конструкцию, свернув свинцовые пластины в рулон и, соответственно, увеличив их площадь, при малом объёме можно добиться неплохих показателей такого устройства. По этому же принципу делают рулоны в современных гелевых накопителях энергии.

Пластины, подготовленные к погружению в банку
Важно! При работе с самодельными электронакопителями соблюдайте правила безопасности: кислота, использованная в электролите, – довольно агрессивное вещество
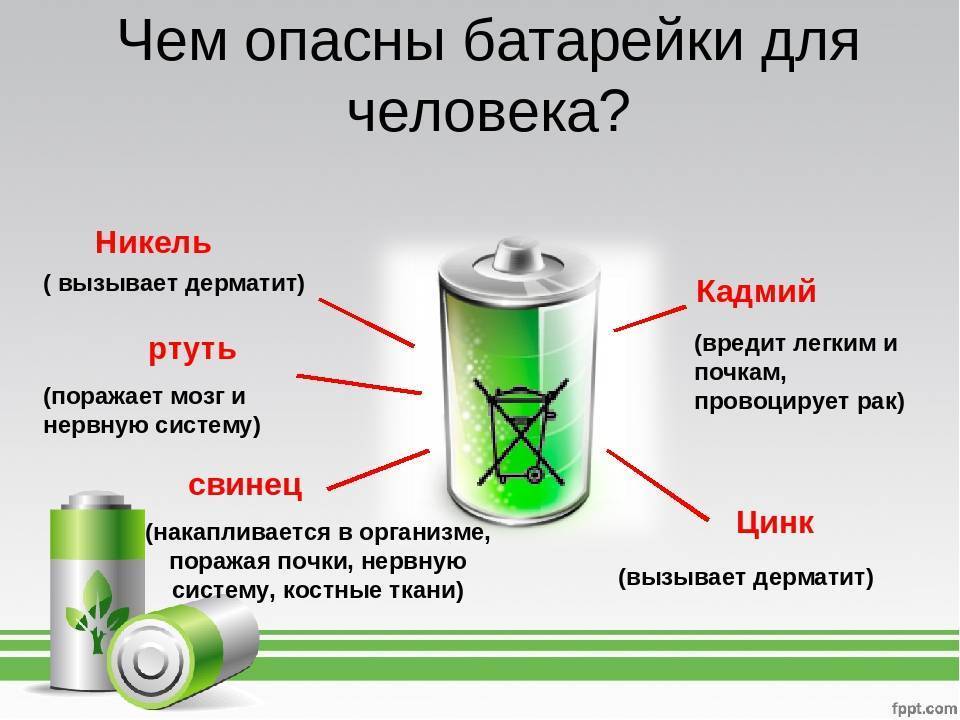
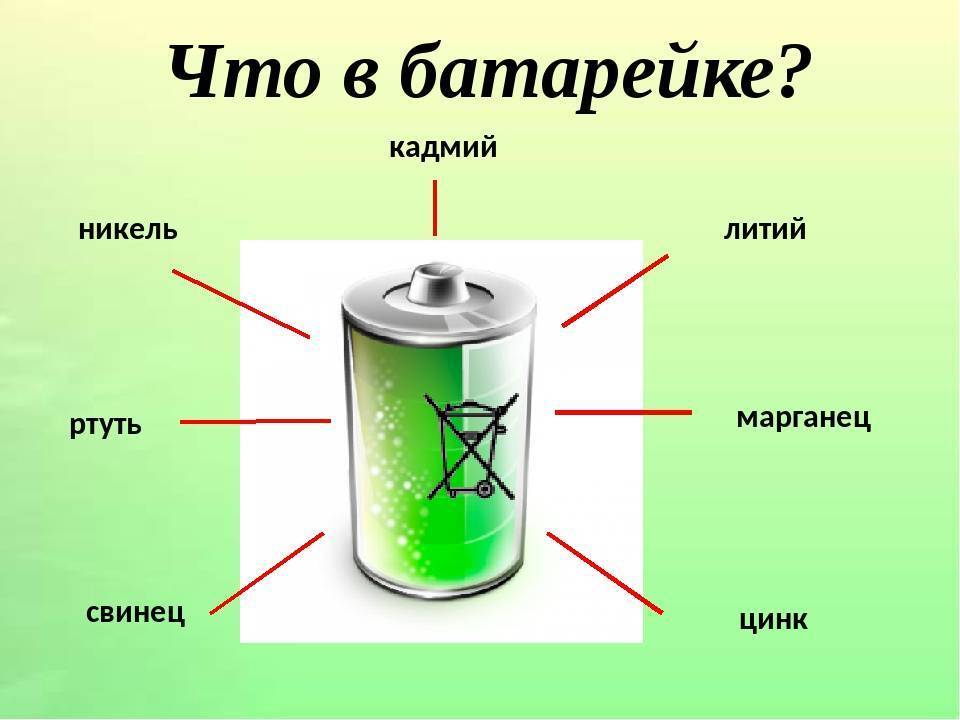
Опасные и ядовитые вещества
При этом, под корпусом батарейки в зависимости от ее типа запрятано множество элементов: литий, свинец, кадмий, ртуть, никель, цинк, марганец.
Литий, цинк и марганец относительно безопасны. Что касается цинка, то его содержание в маленьких источниках питания даже больше чем в руде, из которой его добывают.
А вот ртуть относится к чрезвычайно опасным веществам, которые вызывают отравления.
Кадмий — канцероген, оседающий в почках, печени и щитовидной железе человека. Он поражает работу каждого органа в организме.
Свинец напрямую сказывается на репродуктивном здоровье.
Правда в современных моделях нет такого количества токсичных компонентов. В телефонах, смартфонах и т.п. сейчас используются большей частью литий-ионные аккумуляторы. Опасность же представляют не они, а никель-кадмиевые.
Получается, что каждая батарейка содержит в себе немного яда. Что произойдет с этим ядом, после того как источник питания оказался в мусорном ведре?
Есть два пути:
Если батарейку сжечь, все токсичные вещества, диоксиды сразу же окажутся в атмосфере. Сжигать нужно по уму, при температуре 1200 градусов, с использованием специального очистительного оборудования.
Построить такой завод стоит около 800 млн. евро. Поэтому редко где они есть.
На свалке для полного разложения батарейки нужно около 100 лет. Фактически, еще ни один источник питания выпущенный в мире, не подвергся сто процентному разложению. Зато, чтобы разрушиться от коррозии верхнему слою, иногда требуется всего 6-7 недель.
После чего, металлы начинают отравлять почву, грунтовые воды, водоемы, которые мы используем для ловли рыбы и питьевого водоснабжения.
Как уверяют экологи, одна единственная пальчиковая батарейка может загрязнить примерно 20м2 почвы или 400л питьевой воды.
А на этой почве могут быть выращены в будущем фрукты и овощи. Более того, контакт даже сильно разряженной батарейки и фольги от шоколадки, может вызвать разогрев.
Поэтому большие свалки и горят одна за другой. Необязательно их специально поджигать.
Это интересно: Почему зарядку нельзя оставлять в розетке, чем это чревато — разбираемся во всех подробностях
Аварийный источник энергии
Описанный выше принцип можно использовать для создания зарядного устройства из подручных средств. Для этого понадобятся простые детали, которые можно обнаружить в остатках материала на выброс после ремонта.
Для создания источника энергии понадобится:
- П-образные оцинкованные подвесы для гипсокартона (толщина значения не имеет) — 10 шт.
- Тонкая медная проволока — 15 м.
- Тонкая х/б ткань — несколько лоскутов, в крайнем случае — туалетная бумага.
- Нитки.
- Вода, соль.
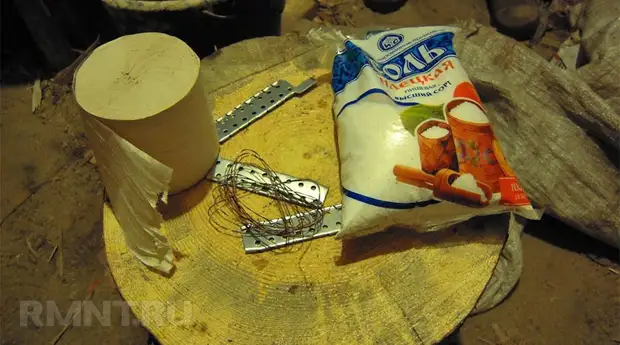
Ход работы (для одного элемента питания):
1. Обернуть пластины материей (или бумагой) в 2 слоя.
2. Намотать проволоку поверх материи (не густо, материя должна просматриваться).
3. От каждого элемента выпустить медный проводок.
4. Обернуть элемент материей ещё раз и зафиксировать нитками.

5. Смочить подсоленной водой материю и поддерживать в мокром состоянии.
Один элемент выдаёт примерно 0,33 В. Для горения светодиода достаточно 5-ти элементов, для подзарядки телефона 13–14 шт.

Электричество будет вырабатываться, пока идёт реакция окисления, т.е. пока между разными металлами есть электролит (подсоленная вода). Если элемент высох, достаточно его смочить, и реакция возобновится, пока соляной раствор не разъест цинковое покрытие. В идеале лучше использовать полностью цинковые пластины.
Отдельные детали и соль можно взять с собой в поход или держать уже готовые элементы вместе со свечой на случай отключения электричества. При наступлении темноты останется только соединить их вместе и смочить.
САМОДЕЛЬНЫЙ АККУМУЛЯТОР
Сегодня мы изготовим достаточно простое устройство, а точнее источник питания — самодельный аккумулятор напряжения. Как известно, два разных металла погруженные в раствор электролита, способны в себе накапливать электрический ток. В качестве электродов было решено использовать медную и алюминиевую фольгу (на мой взгляд они самые доступные).

Кроме фольги нам еще понадобится — лист бумаги, прозрачный скотч и сам сосуд, в котором мы поместим банку аккумулятора (очень удобно использование стеклянного сосуда из — под нафтизина или валерианных таблеток).

Смотрим на фотографии.

Фольги почти одинакового размера, только алюминиевая фольга чуть длиннее, причины этому нет, просто на медную фольгу легче нанести припой, чем на алюминиевую и провод к фольге не припаян, просто свернут в нее затем зажат при помощи плоскогубцы.

Далее обе фольги были завернуты в лист бумаги. Не допустимо касание металлов друг к другу, между ними ограждением служит лист бумаги. Затем фольги нужно взять вместе и завернуть в кружок и обмотать ниткой или прозрачным скотчем.

Затем изготовленный сверток нужно поместить в сосуд. После этого берем 50 мл воды и разбавляем в нее 10 — 20 граммов соли. Раствор хорошенько перемешиваем и подогреваем до тех пор, пока вся соль не расплавится.

После расплавления соли раствор заливаем в сосуд, где у нас готовая заготовка для нашего самодельного аккумулятора. После заливки ждем несколько минут и измеряем напряжение на проводах аккумулятора. Забыл уточнить полярность аккумулятора, медная фольга — плюс питания, алюминиевая соответственно минус. Измерения покажут напряжение порядка 0,5-0,7 вольт. Но первоначальное напряжение ни о чем не говорит. Нужно зарядить наш аккумулятор. Заряжать можно от любого источника постоянного тока с напряжением 2,5-3 вольт, зарядка длится пол часа. После зарядки опять измеряем напряжение, оно возросло до 1,3 вольт и может достигать до 1,45 вольт. Максимальный ток такого самодельного аккумулятора может достигать до 350 миллиампер.

Можно изготовить несколько таких аккумуляторов и использовать как резервный источник питания скажем для светодиодной панели или фонаря. Для повышения мощности аккумулятора можно использовать фольгу больших размеров, но конечно такой самопальный аккумулятор держать заряд будет не очень долго (в течении одной недели заряд иссякнет), еще один минус — малый срок службы (не более 3 месяцев), поскольку на меди образуется оксид а во время процесса заряд-разряд алюминиевая фольга начинает поддаваться коррозии и постепенно разделится на мелкие кусочки, но думаю для экспериментов стоит попробовать собрать такой простенький аккумулятор.
Поделитесь полезными схемами
| СЕТЕВОЙ БЛОК ПИТАНИЯ НА 5 ВОЛЬТ Само устройство состоит из нескольких деталей и наладки не требует, работает сразу после включения. На выходе строго 5 вольт, хотя блок питания и не содержит понижающего сетевого трансформатора. |
| ВЫПРЯМИТЕЛЬ НАПРЯЖЕНИЯ
|
| САМОДЕЛЬНЫЙ ВЫСОКОВОЛЬТНЫЙ ГЕНЕРАТОР Провел множество экспериментов и обнаружил много интересных вещей: Один провод заземлен на батарею, второй подключен к обычной лампочке. Внутри ионизируется аргон, которым она заполнена, создавая красивые эффекты. Также ее можно брать руками — ионизация еще сильнее. |
| ЗВУКОВОЙ АНАЛИЗАТОР СПЕКТРА Схема и видеоролик работы анализатора самодельного спектра звука по частотам, на основе микроконтроллера Atmega8-16PU. |
| ПРОСТОЙ ВИДЕОПЕРЕДАТЧИК Как передавать изображение и звук с видеокамеры-глазка на телевизор, без использования проводов — схема и практическая сборка устройства. |
samodelnie.ru
Пример извлечения свинца из батареек
Свинец – наиболее популярный металл, применяемый для создания компактных источников питания. Он относительно дешёвый и не требует определённых условий при транспортировке и хранении. Как правильно утилизировать свинцовые батарейки описано далее.
Последовательность переработки свинца из аккумуляторов:
- Переработка батареек происходит в бетонном резервуаре, верхнюю часть которого занимает электромагнит. Нижняя часть отделена от середины мелкоячеистой сеткой. Батарейки, в их первоначальном виде, загружают в резервуар.
- После резервуара, где электролит стекает в нижнюю часть, а лишние металлы притягиваются электромагнитом, батарейки попадают в механическую дробилку.
- Специальные устройства распыляют воду под большим давлением, что позволяет разделить мелкие куски батареек от крупных. Крупные попадают на дальнейшую переработку, мелкие – окончательно утилизируются.
- Крупные части батареек проходят обработку каустической солью, где становятся цельной свинцовой массой, годной для переплавки.
- Полученную массу отправляют в плавильню, после которой свинец сортируется согласно качеству или количеству примесей.
Данный метод подходит только для источников питания, основным элементов которых является свинец.
Кадмиевая или литийионная батарейка требует другого подхода. Универсального метода переработки, подходящего для всех разновидностей батареек, не существует.
История обыкновенной батарейки
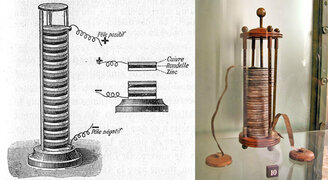
Слово «батарея», происходящее от французского слова «batterie», давно вошло в русский язык.
Название происходит от артиллерийской батареи, как исторически первого типа батарей. Впоследствии название стало употребляться для обозначения соединения однотипных предметов вообще.
Официальное рождение батареи относят к 1800 г., когда итальянский физик Алессандро Вольта, основываясь на опытах итальянского врача и анатома Луиджи Гальвани, сделал устройство, получившее впоследствии название «вольтов столб». Сложив стопку высотой полметра из пластинок цинка, меди и войлока, смоченного раствором серной кислоты, Вольта, приложив руки к концам стопки, получил весьма чувствительный удар током. Так началась электрическая эра.
Изобретение Алессандро Вольта произвело фурор в обществе, Вольта осыпали почестями и наградами, его именем назвали единицу электрического напряжения. Свою долю славы получил и Луиджи Гальвани. В его честь электрохимический элемент, изобретенный Вольта, называется гальваническим.
Гальванические элементы делятся на два типа – первичные и вторичные.
Все батарейки являются первичными гальваническими элементами.
Вторичные гальванические элементы – элементы, в которых электрическая энергия от внешнего источника тока превращается в химическую энергию и накапливается, а затем, при необходимости, химическая энергия снова превращается в электрическую. Эти вторичные элементы называются аккумуляторами.
Одним из первых гальванических элементов, которым можно было пользоваться вне лабораторий, был изобретен Жоржем Лекланше в 1866 году.
Конструкция имени Лекланше проста — цинковый анод, катод из диоксида марганца с углем, размещенные в электролите из хлорида аммония, т.е. соли аммония.
В течении некоторого времени элемент Лекланше претерпел изменения: цинковый анод стал делаться в виде цинкового стаканчика, в стаканчике размещен катод из смеси диоксида марганца и графита, в центре катода находится угольный стержень, являющийся токосъемником, катод окружен электролитом из хлорида аммония с добавкой хлорида цинка, только не в жидком виде, как у Лекланше, а в загущенном, в виде геля, из-за добавления крахмала и муки. Это необходимо для того, чтобы электролит не мог вытечь или высохнуть при хранении и эксплуатации элемента.
Элементы с загущенным электролитом получили название «сухие батареи».

Одним из всплесков было появление щелочных батарей. Впервые щелочные батарейки выпустила компания Eveready (ныне Energizer) в 1959г. Принцип ее работы практически идентичен принципу работы солевой батареи – анод из цинка, катод из диоксида марганца, единственное отличие в составе электролита – он не из соли аммония, как в солевой, а из раствора щёлочи, обычно гидроксида калия. У щелочной батареи анод в виде пасты из цинкового порошка в смеси с электролитом находится внутри катода из смеси диоксида марганца с графитом.
Анод и катод разделены тонким сепаратором, пропитанным электролитом, и все это располагается в стальном корпусе. Получается, что если у солевого элемента корпус (-), а центральный токоотвод (+), то у щелочного элемента все наоборот, корпус (+), а центральный токоотвод (-).

Такая конструкция, разумеется, сделана не просто так. В солевых элементах при химической реакции расходуются все реагенты, составляющие этот элемент — анод, катод, электролит. А в щелочном элементе при химической реакции расходуется только анод и катод, электролит не расходуется. Поэтому электролита там совсем мало, и освободившееся место электролита заполнено увеличенным количеством анода и катода, что значительно увеличивает электроемкость щелочного элемента.
Форм-фактор распространенных гальванических элементов

Соль, уголь и графит
Какой аккумулятор выбрать
Для этого устройства не нужна кислота, так как используется щелочная реакция. Как сделать аккумулятор этого типа? Основой накопителя энергии этого типа служит ёмкость с электролитом в виде раствора воды и хлорида натрия – поваренной соли. Для его создания требуются:
- графитовые стержни, с металлическим колпачком для припаивания контакта;
- активированный или древесный уголь, истолчённый в крошку;
- тканевые мешки для размещения угольного порошка;
- ёмкость для электролита с плотной крышкой для фиксации концов электрода.
В качестве электродов служит графитовый стержень в плотной угольной обкладке. Графит можно использовать из пришедших в негодность батареек, а уголь – древесный или активированный, из противогазных фильтров. Для создания плотной обкладки уголь можно поместить в водопроницаемый мешок, после чего вставить внутрь графитовый стержень, а ткань мешка обмотать нитью или проводом с изоляционным покрытием.
Для увеличения показателей этого рода конструкции можно создать батарею из нескольких электродов, размещённых в одной ёмкости.

Газовый накопитель
Важно! Накопительная ёмкость и напряжение на контактах самодельных устройств для накопления электроэнергии сравнительно невелики, но в то же время их вполне хватает для подключения маломощного источника света или других целей. Батарея из нескольких электродов имеет более высокие показатели, но они более громоздкие
Устройство батарейки
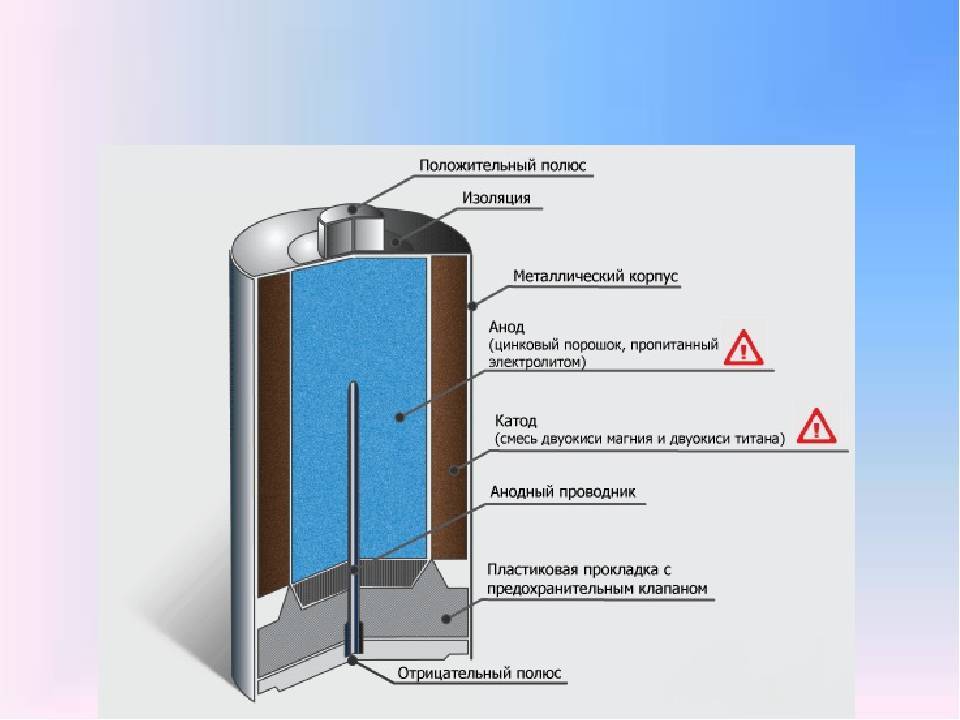
Конструкционные особенности батареек связаны, прежде всего, с их размерами и формой.
Цилиндрической
Цилиндрическая батарейка имеет вытянутый корпус. Оболочка в таких элементах чаще состоит из металла. Эта часть надёжно изолирована от внутренних деталей.
Сразу после диэлектрической оболочки следует тонкий стакан из токопроводящего металла (цинка в солевых батареях). Этот элемент соединяется с отрицательным выводом батарейки.
В середине цилиндрического элемента питания располагается графитовый стрежень, который является положительным выводом. В контактной части на эту деталь надевается металлический колпачок для защиты от механических повреждений.
В пространстве между центральным стержнем и отрицательной оболочкой находится электролит и деполяризующая смесь.
Круглой (миниатюрной)
Кнопочная батарея является незаменимым элементом питания в наручных часах и других миниатюрных электрических устройствах. Срок службы таких батареек, как правило, выше чем у пальчиковых, но причина длительной работы связана, прежде всего, с небольшим электропотреблением устройств, в которые устанавливается данный элемент.
Состоит такая батарейка из положительного и отрицательного полюсов, между которыми находятся вещества, вступающие в химическую реакцию при подключении к источнику тока потребителей.
Разноимённые контакты в таких изделиях надёжно изолированы друг от друга диэлектрическим материалом. Наиболее часто кнопочные батареи производят по воздушно-цинковой технологии.
Крона
Крона отличается от других батареек тем, что внутри элемента находится 6 небольших источников питания по 1,5 Вольт. Принцип работы каждого отдельного изделия не отличается от пальчиковых или кнопочных батарей.
Корпус батарейки «Крона» изготавливается из металла, но также может использоваться прочный пластик. Отдельные элементы располагаются сверху вниз и подключаются последовательно. Положительный и отрицательный выводы находятся на одной из плоскостей, которая изготавливается из диэлектрика.
Типы батареек
Что это такое солевые батарейки
Солевая батарейка изготавливается из пассивного угля и двуокиси марганца, электролит из хлорида аммония и катод из цинка. В перерывах работы элементы питания могут восстанавливаться, т.е. выравнивать локальные неоднородности в композите электролита, вызванных разрядом. Такой процесс немного продлевает срок службы батарейки.

Алкалиновые (щёлочные) батарейки
Алкалиновые (щелочные) батарейки что это такое
В отличие от солевых батарей у алкалиновой батарейки химический элемент электролита — щелочной. Щёлочные батарейки (алкалин) имеют продолжительный срок хранения, а в процессе эксплуатации напряжение на электродах меняется гораздо меньше, чем у элементов с солевым раствором.

Литиевые батарейки — li ion
Литиевые батарейки — что это такое?
Самые современные. В отличие от щелочных и солевых батареек, в состав катода входит литий (Li – наивысший отрицательный потенциал), в состав анода — различные материалы. Электролит — органический электролит. В связи с такими элементами литиевые батарейки получили большой срок хранения, большую плотность энергии и различную рабочую температуру.
Выводы
Из рассмотренных выше методов видно, что в земле присутствует как огромные запасы статического электричества, так и большой потенциал других видов энергии, которую можно поставить на службу человеку. Для этого нет нужды сжигать топливо, однако не один из способов не дает возможности запитать мощный прибор.
Поэтому куда выгоднее в качестве альтернативных источников получения электричества использовать те же солнечные батареи или ветрогенераторы. Дальнейшее изучение методов генерации электричества из земли может принести более продуктивные результаты, но сегодня мы можем довольствоваться лишь энергией ради эксперимента.
Источник